Química
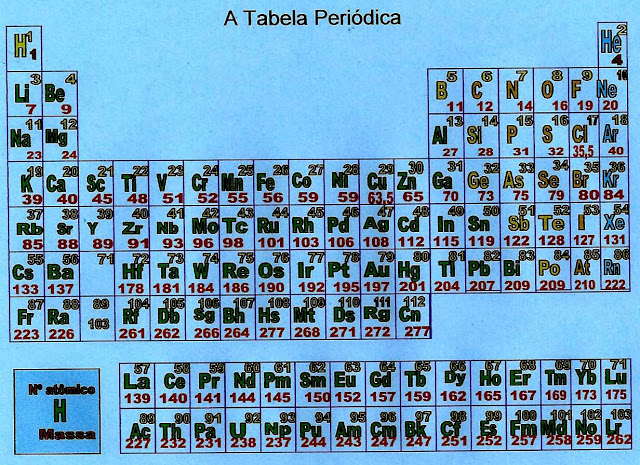




Os Elementos Químicos Não Metálicos da Tabela Periódica
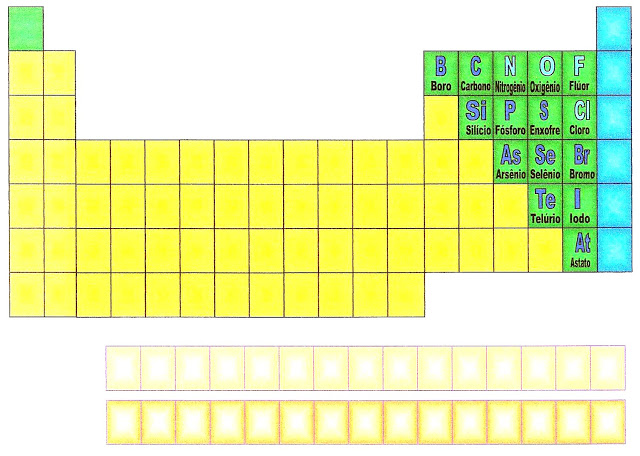
Nomes dos elementos químicos do grupo dos lantanídios

Nomes dos elementos químicos do grupo dos actinídios
Os Elementos Químicos Das Famílias 1A até 8A
Os Elementos Químicos de Transição da Tabela Periódica
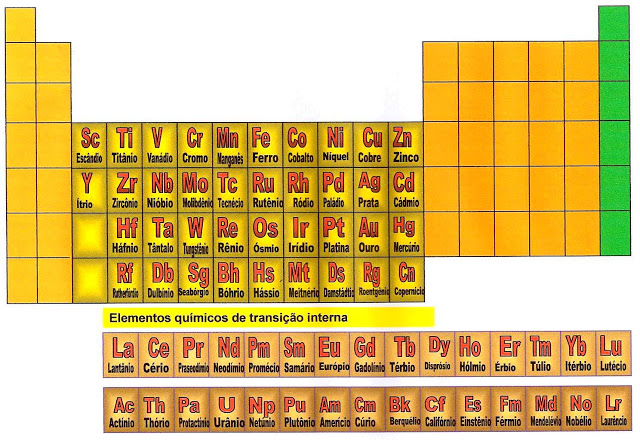 Outra característica dos metais de transição interna é que na distribuição de seus elétrons, o término desses se dá no subnível 4s2 e 3d1 a 10 , 5s2 e 4d 1 a 10, 6s2 e 5d1 a 10, 7s2 e 6d 1 a 10.
Outra característica dos metais de transição interna é que na distribuição de seus elétrons, o término desses se dá no subnível 4s2 e 3d1 a 10 , 5s2 e 4d 1 a 10, 6s2 e 5d1 a 10, 7s2 e 6d 1 a 10.
Tabela Periódica
Avaliação Sobre a Tabela Periódica
- Os Actinídeos
Bolsista: Edlane Lucia Olá meus queridos do QuiPIBID! Conhecemos na última matéria os elementos da família dos lantanídeos, agora, vamos conhecer a família dos actinídeos. Os actinídeos estão localizados na tabela periódica abaixo...
- Os Lantanídeos
Bolsista: Edlane Lucia S. Silva Olá meus queridos do quipibid! Mais uma vez estamos juntos para compreendermos os elementos químicos da tabela periódica e desta vez vamos falar sobre os elementos do grupo dos lantanídeos ou também conhecidos...
- ?novas EvidÊncias Da ExistÊncia Do Elemento 113 Da Tabela PeriÓdica?
Bolsista: Alessandro R. Barbosa Oi seguidores e amigos do QUIPIBID! Hoje atualizamos nossa coluna de atualidades com uma reportagem do portal G1, sobre cientistas japoneses que dizem ter conseguido criar elemento 113 da tabela periódica....
- História Da Tabela Periódica
...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
Química
A tabela Periódica

A Estrutura da Tabela Periódica
Os Períodos da Tabela Periódica
Os períodos da tabela periódica estão dispostos horizontalmente e são sete. O primeiro período é muito curto contém apenas dois elementos químicos, o segundo e o terceiro período são curtos, contém 8 elementos químicos cada, o quarto e o quinto período são longos, contém dezoito elementos químicos cada um, o sexto perído é superlongo possui 32 elementos químicos, o sétimo periodo é incompleto, é onde estão localizados os elementos químicos não naturais ou "artificiais".

Colunas e (ou) Famílias Dos Elementos Químicos da Tabela Periódica
As famílias ou colunas da tabela periódica são 18. São oito colunas dos elementos químicos pertencentes ao grupo A e dez colunas pertencentes aos do grupo B.


Os Metais na Tabela Periódica
Os metais da tabela periódica estão representados nas cores amarelo e alaranjado. Compreendem os metais pertencentes ao grupo dos alcalinos (Família 1A) , alcalinos terrosos (família 2A), os da família do boro (3A) do carbono (4A) e dois na família do nitrogênio (5A) e um metal na família do oxigênio (6A). No centro da tabela estão os metais de transição e localizados abaixo, os lantanídios e os actinídios também chamados de transição interna.

Os Elementos Químicos Não Metálicos da Tabela Periódica

Os Lantanídios
Os Lantanídios são elementos químicos que formam um grupo com mais ou menos 15 elementos, começando pelo lantânio e terminando no lutécio são metais de transição interna. Por uma questão prática estão inseridos no sexto período a partir da terceira casinha na primeira coluna dos metais de transição da tabela periódica. Os lantanídios tem o significado de elementos químicos metálicos de terras raras porque antigamente eram encontrados localizados apenas em certos lugares. Atualmente são tratados na categoria de metais macios maleáveis e podem ser encontrados conjuntamente agrupados ou como óxidos e minerais na forma de bastnasita (Ce,La,Y)CO3F, monazita (Ce, La, Pr, Nd, Th, Y)PO4 (há vários tipos de monazita), loparita (Ce,Na,Ca)(Ti,Nb)O3, e silicatos (argilas lateríticas) como no caso da gadolinita ou gadolinite de fórmula (La,Ce,Nd,Y)2FeBe2Si2O10. O nome da gadolinita deriva da quantidade de elementos específicos participantes na sua fórmula, por exemplo: se predominar cério (Ce) a gadolinita associa sua nomenclatura a esse elemento químico, se predominar o ítrio (Y) a gadolinita associa o ítrio ao nome do composto.
Nomes dos elementos químicos do grupo dos lantanídios
La - Lantânio |
Ce - Cério |
Pr - Praseodímio |
Nd - Neodímio |
Pm - Promécio |
Sm - Samário |
Eu - Európio |
Gd - Gadolínio |
Tb - Térbio |
Dy - Disprósio |
Ho - Hólmio |
Er - Érbio |
Tu - Túlio |
Yb - Itérbio |
Lu - Lutécio |
Os Actinídios

Os actinídios formam um grupo com mais ou menos 15 elementos químicos, começando pelo actínio e terminando no laurêncio, são metais de transição interna. Estão localizados no sétimo período da tabela periódica, na terceira casinha. Actinídios significa elementos químicos metálicos radioativos.
Nomes dos elementos químicos do grupo dos actinídios
Ac - Actínio |
Th - Tório |
Pa - Protactínio |
U - Urânio |
Np - Netúnio |
Pu - Plutônio |
Am - Amerício |
Cm - Cúrio |
Bk - Berquélio |
Cf - Califórnio |
Es - Einstênio |
Fm - Férmio |
Md - Mendelévio |
No - Nobélio |
Lr - Laurêncio |
Os Elementos Químicos Das Famílias 1A até 8A
Número da coluna | Nome das famílias | Elementos dessas famílias |
1A | Metais Alcalinos | Li, Na, K, Rb, Cs, Fr |
2A | Metais alcalinos terrosos | Be,Mg,Ca, Sr,Ba,Ra |
3A | Família do boro | B, Al, Ga, In, Ti |
4A | Família do carbono | C, Si, Ge, Sn, Ph |
5A | Família do nitrogênio | N, P, As, Sh, Bi |
6A | Família do oxigênio | O, S, Se, Te, Po |
7A | Família dos halogênios | F, Cl, Br, I, At |
8A ou zero | Família dos gases nobres | He, Ne, Ar, Kr, Xe, Rn |
O Número de Elétrons Por Família
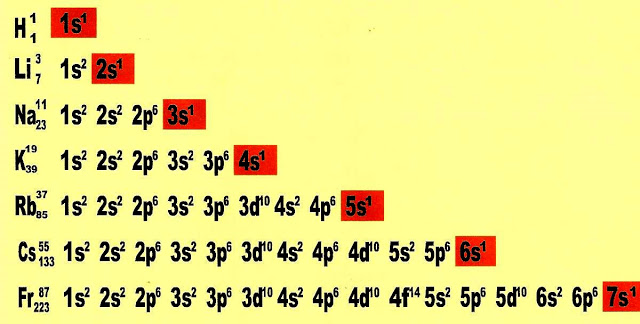
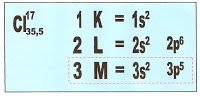
A família 1A possui na camada de valência 1 elétron, a valência é 1.
A família 2A possui na camada de valência 2 elétrons, a valência é 2.
A família 3A possui na camada de valência 3 elétrons, a valência é 3.
A família 4A possui na camada de valência 4 elétrons, a valência é 4.
A família 5A possui na camada de valência 5 elétrons, a valência é 3.
A família 6A possui na camada de valência 6 elétrons, a valência é 2.
A família 7A possui na camada de valência 7 elétrons, a valência é 1.
A família 8A possui na camada de valência 8 elétrons, a valência é zero todos os orbitais estão completos.
A família 1A possui na camada de valência 1 elétron. Observemos a distribuição eletrônica de cada um dos elementos químicos integrantes desse grupo.

Os Elementos Químicos de Transição da Tabela Periódica
Os elementos químicos de transição interna estão localizados no centro da tabela periódica. Esses elementos químicos possuem propriedades com características próprias como: maleabilidade, geralmente os metais de transição são bens maleáveis e podem ser distendidos em fios ou lâminas, são bons condutores de eletricidade e calor.

Tabela Periódica
Avaliação Sobre a Tabela Periódica
Questões
1) A tabela periódica moderna ou de Moseley foi organizada:
a) Com os elementos químicos em ordem crescente de seus números atômicos em linhas verticais.
b) Com os elementos químicos em ordem decrescente de seus números atômicos e em linhas horizontais.
c) Com os elementos químicos em ordem crescente de seus números atômicos em linhas horizontais.
d) Com os elementos químicos de propriedades semelhantes, crescente em linhas horizontais.
e) Com os elementos químicos em ordem crescente de seus volumes, ponto de fusão e de ebulição.
2) O número dos períodos e as sua disposições na tabela periódica são respectivamente:
a) Sete e estão dispostos em sete linhas verticais.
b) Sete e estão dispostos na tabela periódica em sete linhas horizontais.
c) 18 e estão dispostos em 18 linhas horizontais.
d) 8 e estão dispostos em 8 colunas verticais.
e) 9 e estão dispostos em 9 linhas horizontais.
3) Os períodos da tabela periódica, a extensão e o número de elementos químicos respectivamente são:
a) Sete: e o período mais longo é o quinto que tem 32 elementos químicos, porque estão incluído nesse período os metais.
b) Sete: e o período mais longo é o quarto, porque nele estão incluídos todos os elementos de transição interna.
c) Dezoito: e o período mais longo é o sétimo que tem32 elementos químicos, porque estão incluídos nesse período os gases nobres.
d) Sete: e o período mais longo é o sexto que tem 32 elementos químicos, porque nele estão incluídos os lantanídios.
e) Oito: e o período mais longo é o sétimo que é incompleto, mas tem 32 elementos químicos, porque estão incluídos os actinídios.
4) A localização na tabela periódica e o significado de lantanídios pode ser descrito respectivamente:
a) No sexto período e significa elementos químicos de terra roxa. ( terno usado atualmente).
b) No quinto período e significa elementos químicos radioativos. (termo usado atualmente).
c) No sexto período e significa elementos químicos não metálicos ( termo usado atualmente).
d) No sexto período e significa elementos químicos de terras raras ( termo usado mais antigo).
e) No sétimo período e significa elementos químicos alcalinos.( termo usado atualmente).
5) As colunas ou os grupos das famílias são:
a) dezoito, oito do grupo A e dez do grupo B. Estão ordenadas horizontalmente na tabela periódica.
b) dezoito do grupo B e dez do grupo A. Estão ordenadas em camadas na tabela periódica.
c) oito do grupo A e B. Todos elas estão ordenadas horizontalmente na tabela periódica.
d) Trinta e duas. Dezesseis do grupo A e dezesseis do grupo B. Estão ordenadas verticalmente na tabela periódica.
e) dezoito. Oito do grupo A, dez do grupo B. Estão ordenadas verticalmente na tabela periódica.
6) Os metais alcalinos estão situados em qual coluna na tabela periódica, terminam a distribuição eletrônica com quantos elétrons e formam quais íons respectivamente?
a) Na coluna 1A e são 6 esses elementos químicos, terminam a sua distribuição eletrônica com 2 elétrons cada um, portanto ao se ionizarem formam cátions bivalentes.
b) Na coluna 2A e são 7 elementos, terminam a sua distribuição eletrônica com 2 elétrons cada um, portanto ao se ionizarem formam cátions bivalentes.
c) Na coluna 8A e são 6 elementos químicos, terminam a sua distribuição eletrônica com 8 elétrons cada um, portanto não se ionizam pois são os gases nobres.
d) Na coluna 1B e são 5 elementos químicos, terminam a sua distribuição eletrônica com 2 e 9 elétrons cada. Forma cátions bivalentes.
e) Na coluna 3B e são 5 elementos químicos, terminam a sua distribuição eletrônica com 3 elementos, portanto formam cátions trivalentes.
7) Os elementos químicos da família dos metais alcalinos terrosos são respectivamente:
a) He, Ne, Ar, Kr, Rn.
b) F, Cl, Br, I, At.
c) Li, Na, K, Rb, Cs, Fr.
d) Be, Mg, Ca, Sr, Ba, Ra.
e) B, Al, Ga, In, Ti.
8) A família 7A dos elementos químicos, cada dos componentes desse grupo possui:

a) na última camada da distribuição eletrônica 7 elétrons, portanto a sua valência é -7.
b) na última camada da distribuição eletrônica 7 elétrons, portanto a sua valência é +1.
c) na última camada da distribuição eletrônica 3 elétrons, portanto a sua valência é +5.
d) na última camada da distribuição eletrônica 7 elementos químicos, portanto a sua valência é 1.
e) na última camada da distribuição eletrônica 2 elétrons portanto a sua valência é 2.
9) Os elementos químicos, metais de transição, estão situados na tabela periódica:
a) No centro a partir do quarto período e são todos eles pertencentes ás colunas 3 até 12, designadas pela letra B e o seu elétron mais energético está no subnível d.
b) Nas laterais a partir do terceiro período e são todos eles pertencentes ás colunas 3 até 12 designadas pela letra A e o seu elétron mais energético está no subnível p.
c) No centro a partir do segundo período e são todos eles pertencentes ás colunas 1A até 8A designadas pela letra A e o seu elétron mais energético está no subnível s.
d) No centro a partir do quarto período e são todos eles pertencentes ás colunas 3 até 18 designadas pela letra B e o seu elétron mais energético está no subnível p.
e) No centro a partir do quinta período e são todos eles pertencentes ás colunas 3 até 12 designadas pelas letras A e B e o seu elétron mais energético está no subnível s.
10) Com relação ao uso do elemento químico manganês (Mn) podemos dizer que:
a) É utilizado como desinfetante de água, é empregado como branqueador de material de celulose, na fabricação de plásticos, é utilizado frequentemente como removedor de manchas.
b) É utilizado como purificador de água, como gás lacrimogênio, como retardador de chamas, como desinfetante, como papel fotográfico e tem o seu uso também como sensibilizador de filmes de câmeras não digitais.
c) É utilizado na produção de aço dos trilhos de trens, na produção de ferramentas variadas, em eixo de rodas, cofres, arados, acumuladores, na produção de vidros e do pigmento preto.
d) É utilizado em criocirurgia, no estado líquido na conservação de sêmen, na preparação do amoníaco, é utilizado como combustível para foguetes, nos adubos e no preparo de explosivos.
e) É utilizado na fabricação de fósforos, fogos de artifício, da pólvora, em acumuladores, é um dos componentes do ácido sulfúrico, entra na vulcanização da borracha, está incluído também nas fórmulas dos líquidos usados para cabelos.
11) Com relação ao uso do elemento químico nitrogênio (N2) na fórmula molecular podemos dizer que:
a) É utilizado como desinfetante de água, é empregado como branqueador de material de celulose, na fabricação de plásticos, é utilizado frequentemente como removedor de manchas.
b) É utilizado como purificador de água, como gás lacrimogênio, como retardador de chamas, como desinfetante, como papel fotográfico e tem o seu uso também como sensibilizador de filmes de câmeras não digitais.
c) É utilizado na produção de aço dos trilhos de trens, na produção de ferramentas variadas, em eixo de rodas, cofres, arados, acumuladores, na produção de vidros e do pigmento preto.
d) É utilizado em criocirurgia, no estado líquido na conservação de sêmen, na preparação do amoníaco, é utilizado como combustível para foguetes, nos adubos e no preparo de explosivos.
e) É utilizado na fabricação de fósforos, fogos de artifício, da pólvora, em acumuladores, é um dos componentes do ácido sulfúrico, entra na vulcanização da borracha, está incluído também nas fórmulas dos líquidos usados nos cabelos em ?permanentes?.
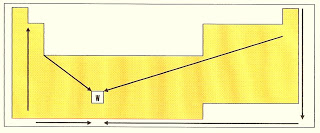
12) Observe a estrutura abaixo. Os sentidos das flechas indicam que:

a) Com exceção dos gases nobres e dos elementos de transição, o ponto de ebulição e de fusão em um período crescem das extremidades para o centro, e numa família de cima para baixo.
b) Com exceção dos metais e dos não metais, o ponto de ebulição e de fusão em um período crescem das extremidades para o centro, e numa família de baixo para cima.
c) Com exceção dos metais alcalinos e alcalinos terrosos, os pontos de ebulição e de fusão, em um período, crescem das extremidades para o centro, e numa família de cima para baixo.
d) Com exceção dos metais alcalinos e alcalinos terrosos, os pontos de ebulição e de fusão, em um período crescem do centro para as extremidades, e numa família de baixo para cima.
Texto em construção
Texto em construção
loading...
- Os Actinídeos
Bolsista: Edlane Lucia Olá meus queridos do QuiPIBID! Conhecemos na última matéria os elementos da família dos lantanídeos, agora, vamos conhecer a família dos actinídeos. Os actinídeos estão localizados na tabela periódica abaixo...
- Os Lantanídeos
Bolsista: Edlane Lucia S. Silva Olá meus queridos do quipibid! Mais uma vez estamos juntos para compreendermos os elementos químicos da tabela periódica e desta vez vamos falar sobre os elementos do grupo dos lantanídeos ou também conhecidos...
- ?novas EvidÊncias Da ExistÊncia Do Elemento 113 Da Tabela PeriÓdica?
Bolsista: Alessandro R. Barbosa Oi seguidores e amigos do QUIPIBID! Hoje atualizamos nossa coluna de atualidades com uma reportagem do portal G1, sobre cientistas japoneses que dizem ter conseguido criar elemento 113 da tabela periódica....
- História Da Tabela Periódica
...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
