Química
- Praseodímio (pr)
...
- Gadolínio (gd)
Bolsista:...
- Protactínio (pa)
Bolsista:Leonice Paraguai Olha pessoal! Vamos conhecer mais um ?Elemento Químico?. O elemento de hoje é o Protactínio (Pa), o protactínio não tem aplicações práticas. As pequenas quantidades de Protactínio é cerca de o, 1 ppm de 231 Pa, são...
- Polônio (po)
...
- Fósforo (p)
...
Química
Cério (Ce)
Bolsista: Leonice Paraguai
Olha pessoal! Estou de volta outra vez, para levar algumas informações sobre mais um ?Elemento Químico?. Hoje vamos conhecer um pouquinho do Cério (Ce), um elemento muito utilizado em várias áreas, no inicio das pesquisas não imaginei tanta utilização desse elemento que quase não é mencionado, mas o cério é o mais abundante das Terras Raras. Sua abundância na crosta terrestre é da ordem de 60 ppm,o que o torna o 26º elemento em frequência de ocorrência,sendo quase tão abundante quanto o cobre e níquel. Apesar de o cério ser o lantanídeo de maior ocorrência, é encontrado em muitos minerais somente em níveis traço, sendo a bastinasita e monasita os minerais mais importantes como fonte de cério e suprem a maior parte da demanda mundial deste elemento 1-6. Estes dois minerais, dependendo da localidade dos depósitos, possuem cerca de 65-70% (bastinasita) e 49-74% (monasita)de terras céricas (La-Gd), sendo que,considerando-se a porcentagem de lantanídeos na bastinasita e monasita como 100%, a quantidade de CeO2 corresponde a aproximadamente 49-47%,respectivamente.
O único lantanídeo no estado (+IV), que persiste em solução e tem uma química em solução aquosa é o íon Ce+. É raro encontrar íon com carga 4+em solução. A carga elevada do íon leva a uma intensa hidratação. Assim, exceto em soluções fortemente ácidas, o íon Ce4+ se hidrolisa formando espécies poliméricas e H+. Soluções de Ce (+IV) são largamente usadas como oxidante em análise volumétrica, no lugar de KMnO4 e K2Cr2O7. Na análise clássica, as buretas devem ser lavadas com ácido, pois caso água seja utilizada, corre-se o risco de haver certo grau de hidrólise. Soluções aquosas de Ce (IV) podem ser preparadas oxidando-se uma solução de Ce3+com um agente oxidante muito forte, tal como perodissulfato de amônio, (NH4)2S2O8.
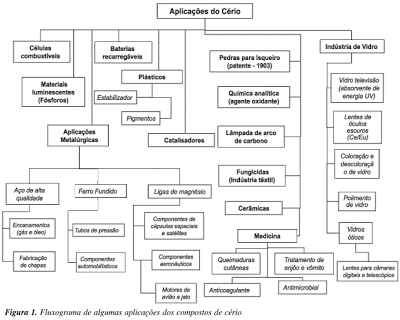
O íon Ce (+IV) também é usado em síntese orgânica, por exemplo, a oxidação do carbono alfa de alcoóis, aldeídos e cetonas. Os compostos mais comuns são CeO2 (branco quando puro) pode ser obtido aquecendo-se o metal, Ce (OH)3 ou CeIII2(oxalato)3 , ao ar. O CeO2 tem uma estrutura do tipo da fluorita. É insolúvel em ácidos e álcalis, mas dissolve-se quando reduzido a Ce3+. Os compostos de cério têm um enorme potencial para aplicação em diversas vertentes tecnológicas, principalmente devido a algumas de suas propriedades, tais como faixa de potencial redox, alta mobilidade de oxigênio na rede cristalina, alta afinidade por compostos contendo oxigênio, nitrogênio e enxofre. Algumas dessas aplicações são mostradas no fluxograma da Figura 1.

Bom pessoal! Estarei de volta na próxima semana com mais um ?Elemento Químico?. Uma ótima semana para todos e lembre-se você sozinho não é capaz de mudar o mundo, mas se você fizer sua parte, estará contribuindo para um mundo melhor.
Referência:
Lee, J. D. Química inorgânica não tão concisa, 5ª ed. São Paulo: Blucher.
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422007000800035
loading...
- Praseodímio (pr)
...
- Gadolínio (gd)
Bolsista:...
- Protactínio (pa)
Bolsista:Leonice Paraguai Olha pessoal! Vamos conhecer mais um ?Elemento Químico?. O elemento de hoje é o Protactínio (Pa), o protactínio não tem aplicações práticas. As pequenas quantidades de Protactínio é cerca de o, 1 ppm de 231 Pa, são...
- Polônio (po)
...
- Fósforo (p)
...
