Química
Colóides
A Definição de Dispersões Coloidais
O significado da palavra colóide ou seja, a partícula da dispersão; vem do grego que significa goma ou cola. Dispersão coloidal não é uma solução verdadeira e também não se qualifica, como por exemplo; uma mistura grosseira de areia com a água, mas estaria entre esses dois estados físicos de substâncias envolventes.
Portanto, distinguem-se por não poderem ser chamadas de soluções porque o "particulado" componente, se encontra acima do tamanho limite das partículas de uma solução verdadeira.
Foi o Inglês Thomas Grahan quem melhor definiu como dispersões coloidais, pois teriam as características intermediárias entre mistura homogênea e mistura heterogênea.
Substância Dispersa
É necessário que haja mais de uma substância formando uma mistura, para que seja um sistema coloidal, o qual é heterogêneo. A substância dispersa na mistura é a que se encontra em menor quantidade.
Substancia Dispergente
Nessa mistura heterogênea a substância dispergente é a que se encontra em maior quantidade promovendo a dispersão da substância em menor quantidade.
Suspensão
É o sistema formado pela mistura heterogênea que contém a substância dispersante e dispergente. É o sistema coloidal ou seja, um sólido disperso em um líquido.
Sol
No sistema coloidal sol, as propriedades das duas substâncias unidas, se apresentam parecidas com líquido, o disperso está na fase sólida e o dispergente está no estado líquido. Um bom exemplo desse sistema é o sangue, que possui partículas sólidas, as hemácias, plaquetas glóbulos brancos e o plasma a parte líquida.
Gel
A substância coloidal na forma de gel, tem a aparência de um sólido. Mesmo assim o disperso está na forma líquida e o dispersante está na forma sólida. O queijo é um sistema coloidal na forma de gel.
Aerossol
O dispergente está na fase gasosa e o disperso está na fase líquida (sprays). A fumaça de cigarro também é um aerossol.
O Tamanho das Partículas Envolventes
Os colóides, componentes das dispersões coloidais se juntam em agregados de macromoléculas ou macroíons com o diâmetro entre 10 a 1000 angstrons. Esses aglomerados não podem ser observados a olho nu.
Se correlacionarmos os valores, angstron e centímetro teremos os seguintes dados:
São Exemplos de Dispersões Coloidais
Aerosol Sólido
Nesse tipo de dispersão coloidal o dispergente está na forma gasosa e o disperso está na forma sólida.
Um bom exemplo desse tipo de dispersão coloidal ou aerosol sólido são as micropartículas de poeira dispersas no ar invisíveis a olho nu, ou a fumaça; a qual possui microgrânulos de cinzas dispersas no ar.
Note-se que, se as partículas de poeira ou da fumaça forem grandes o bastante para serem visíveis a olho nú, elas já não são mais coloides.
Espuma Líquida
É uma dispersão coloidal em que o dispergente está na fase líquida e o disperso está na fase gasosa.
Os Líquidos Utilizados no Dialisador
- Olhando Mais A Fundo Para As Moléculas Dos Sabões...
Os sabões são detergentes (palavra que deriva da palavra latina detergere que significa limpar) pois têm como papel limpar a sujidade não solúvel em água dos tecidos, metais, corpo... mas os sabões são uma classe particular de detergentes. Os...
- Outro Sangue Ii
No artigo anterior desta série, vimos que os perfluorocarbonetos (PFC) são substâncias que possuem um enorme potencial de aplicação em formulações usadas como substitutos do sangue na função de transporte de oxigénio. São estruturalmente semelhantes...
- Dispersões: Colóides, Suspensões E Soluções - Resumo
Dispersões: Colóides, suspensões e soluções Uma dispersão é formada por pelo menos um disperso (soluto) e um dispergente (solvente). Dispersões são sistemas em que o soluto sólido está espalhado uniformemente em toda a mistura. A classificação...
- Atividade De Recuperação De Estudos - Soluções - Atividade N° 01
É hora de exercícios! Nesta atividade os alunos devem observar os conteúdos estudados em sala como: SolubilidadeA solubilidade varia com a temperatura.A solubilidade de alguns solutos aumenta com o aumento da temperatura.A temperatura é um fator...
- Avaliação De Química N° 3 - Soluções
Avaliação de Química Geral1) Calcule a concentração, em g/L e g/ml, de uma solução de nitrato de potássio, sabendo que ela possui 60g do sal em 300 cm3 de solução. 2) (Mackenzie-SP) Qual a concentração, em g/L da solução obtida ao se dissolverem...
Química
Colóides
Colóides
A Definição de Dispersões Coloidais
O significado da palavra colóide ou seja, a partícula da dispersão; vem do grego que significa goma ou cola. Dispersão coloidal não é uma solução verdadeira e também não se qualifica, como por exemplo; uma mistura grosseira de areia com a água, mas estaria entre esses dois estados físicos de substâncias envolventes.
Portanto, distinguem-se por não poderem ser chamadas de soluções porque o "particulado" componente, se encontra acima do tamanho limite das partículas de uma solução verdadeira.
Foi o Inglês Thomas Grahan quem melhor definiu como dispersões coloidais, pois teriam as características intermediárias entre mistura homogênea e mistura heterogênea.
Substância Dispersa
É necessário que haja mais de uma substância formando uma mistura, para que seja um sistema coloidal, o qual é heterogêneo. A substância dispersa na mistura é a que se encontra em menor quantidade.
Substancia Dispergente
Nessa mistura heterogênea a substância dispergente é a que se encontra em maior quantidade promovendo a dispersão da substância em menor quantidade.
Dispergente e Dispersante
Portanto na dispersão coloidal deve existir o disperso e o dispersante. Ao misturarmos maisena (amido de milho) com água, teremos uma dispersão coloidal. O dispergente é a maisena e o dispersante a água.
O leite possui na sua composição o açúcar lactose, gotículas de gordura, proteína caseina e água.
É uma dispersão coloidal devido ao dispergente, a proteína caseina estar dispersa na água que é o seu dispersante (não se considera a lactose e as gotículas de gordura).
Suspensão
É o sistema formado pela mistura heterogênea que contém a substância dispersante e dispergente. É o sistema coloidal ou seja, um sólido disperso em um líquido.
Sol
No sistema coloidal sol, as propriedades das duas substâncias unidas, se apresentam parecidas com líquido, o disperso está na fase sólida e o dispergente está no estado líquido. Um bom exemplo desse sistema é o sangue, que possui partículas sólidas, as hemácias, plaquetas glóbulos brancos e o plasma a parte líquida.
Gel
A substância coloidal na forma de gel, tem a aparência de um sólido. Mesmo assim o disperso está na forma líquida e o dispersante está na forma sólida. O queijo é um sistema coloidal na forma de gel.
Aerossol
O dispergente está na fase gasosa e o disperso está na fase líquida (sprays). A fumaça de cigarro também é um aerossol.
O Tamanho das Partículas Envolventes
Os colóides, componentes das dispersões coloidais se juntam em agregados de macromoléculas ou macroíons com o diâmetro entre 10 a 1000 angstrons. Esses aglomerados não podem ser observados a olho nu.
Se correlacionarmos os valores, angstron e centímetro teremos os seguintes dados:
1 angstron corresponde a 10?8 centímetros.
1 angstron corresponde a 10?8 centímetros = 0,00000001 cm.
10 angstrons corresponde a 10?7 centímetros = 0,00000010 cm.
100 angstrons corresponde a 10?6 centímetros = 0,00000100 cm.
1000 angstrons corresponde a 10?5 centímetros = 0,00001000 cm.
O limite da visão humana a olho nú é de 0,01 mm (milímetro), portanto; o limite máximo do tamanho dos colóides é 100 vezes menor que o alcance da visão humana sem o uso de aparelhos de microscopia.
A Carga Das Partículas Dispergentes
Geralmente as partículas pequenas se juntam para formarem o colóide (macromolécula) por ligações intermoleculares. Por sua vez os colóides formados possuem a sua carga elétrica própria, portanto; para ser uma dispersão coloidal deve haver uma carga elétrica nas suas partículas constituintes. A carga elétrica do disperso é igual para todas as partículas do meio, porque é essa carga elétrica que manterá esses colóides equidistantes uns dos outros criando a repulsão ou dispersão. Se a carga do dispergente for positiva todas as suas partículas serão positivas. Se a carga do dispergente for negativa todas as suas partículas serão negativas e se manterão afastadas umas das outras.
São Exemplos de Dispersões Coloidais
O ar que nos envolve, neblina, fumaça, inseticida de uso doméstico, espuma de sabão, plasma sanguíneo, leite no estado natural, creme chantilly, cremes hidratantes para a pele, musse para cabelos, maionese, amido de milho em água, geléias, gelatina pronta, doce maria-mole, doce suspiro etc.
A Apresentação de Dispersões Coloidais
Os Aerosois Líquidos
Aerosol pode ser definido como material particulado natural ou não, suspenso num gás em movimento contínuo. O dispergente está na fase gasosa e o disperso está na fase líquida.
Exemplo: a neblina, são gotículas de água dispersas no ar. Observe que as moléculas de água podem se agrupar por ligações intermoleculares, por pontes de hidrogênio e formar as partículas do tamanho de um colóide.
Outro exemplo, são os inseticidas de uso doméstico e o coloide desse aerosol é a partícula ativa. Podemos citar particularmente um deles que pertence aos multi inseticidas, muito usado em residências; do grupo das piretrinas e piretroides com o nome comum de D-aletrina, D-tetramentrina e permetrina, que estão na forma líquida e misturados com o gás propelente que pode ser o gás propano ou butano que produz o spray, jato do aerosol.
Aerosol Sólido
Nesse tipo de dispersão coloidal o dispergente está na forma gasosa e o disperso está na forma sólida.
Um bom exemplo desse tipo de dispersão coloidal ou aerosol sólido são as micropartículas de poeira dispersas no ar invisíveis a olho nu, ou a fumaça; a qual possui microgrânulos de cinzas dispersas no ar.
Note-se que, se as partículas de poeira ou da fumaça forem grandes o bastante para serem visíveis a olho nú, elas já não são mais coloides.
Espuma Líquida
É uma dispersão coloidal em que o dispergente está na fase líquida e o disperso está na fase gasosa.
Um exemplo desse tipo de dispersão sob a forma de espuma líquida é o creme chantilly. Nesse caso é o ar que expande o creme, o ar usado é o gás propelente o óxido nitroso (N2O) gás hilariante que possui alta difusibilidade, e está disperso no creme de leite chantilly.
Outro exemplo para espuma líquida é o musse para cabelos que ajuda a modelar os cachos e realça o volume, da mesma forma que no chantilly, o gás está disperso no creme cosmético expandindo-o, com a diferença que o gás usado é o gás propano ou butano.
Espuma Sólida
O doce maria-mole é uma dispersão coloidal na qual os seus componentes o açúcar, gelatina hidratada, e demais componentes estão misturados. A clara de ovo um dos constituintes, é a que possui a substância coloidal que se dispersa no ar e depois é solidificada sob calor ou não, formando a espuma sólida. A albumina, essa proteína da clara do ovo, ao batermos com um garfo ou batedeira tem a capacidade de incorporar ar; se mistura a ele e adquire volume.
Outro exemplo de espuma sólida é o isopor, com o qual se fazem forros de isopor, caixas de isopor, produtos isolantes de temperatura e som, placas de isopor etc. O isopor é o plástico poliestireno (PS) ou o poliuretano expandido pela injeção de ar na hora da preparação. Um dos gases muito comumente utilizado para a expansão é o pentano.
O suspiro é um doce que se apresenta como espuma sólida. É a clara de ovo batida misturada aos poucos com açúcar e depois assado em forno brando.
Gel
Gel são as geleias, tipo; geleias de pêssego, geleias de laranja, de amoras. Gel é um tipo de dispersão coloidal em que o dispergente está na fase sólida.
O disperso está na fase líquida. Nesse caso a água é o disperso na pectina.
O dispergente está na fase sólida, o disperso está na fase líquida.
O disperso está na fase líquida porque a molécula de pectina é altamente hidrofílica. Nesse caso a água é o disperso na pectina.
Géis ou seja; no caso das geleias de frutas o colóide ou o dispersante é a pectina e o disperso está na fase líquida. Aquecida é dissolvida, mas ao contrário ao ser resfriada as suas partículas formam um retículo ramificado dando uma consistência semi-sólida .
Géis ou seja; no caso das geleias de frutas o colóide ou o dispersante é a pectina e o disperso está na fase líquida. Aquecida é dissolvida, mas ao contrário ao ser resfriada as suas partículas formam um retículo ramificado dando uma consistência semi-sólida .
A pectina é um polímero feito de unidades do monômero ácido galacturônico (C6H10O7), que por sua vez é formado pela ramnose (C6H12O5), arabinose (C5H10O5) ou galactose (C6H12O6), pela oxidação do seu carbono de numero 6, etc.
É um polissacarídio que está presente na parede de frutas como a maçã, a ameixa, a framboesa, o marmelo, o limão, a laranja, as uvas pretas, o damasco, a tangerina, o pêssego, a pera e em melões etc. Faz parte de suas cascas e polpas, também é o componente das paredes das plantas em geral. Apresenta solubilidade em água e se torna uma substância viscosa ao aquecer e ao resfriar.
É um polissacarídio que está presente na parede de frutas como a maçã, a ameixa, a framboesa, o marmelo, o limão, a laranja, as uvas pretas, o damasco, a tangerina, o pêssego, a pera e em melões etc. Faz parte de suas cascas e polpas, também é o componente das paredes das plantas em geral. Apresenta solubilidade em água e se torna uma substância viscosa ao aquecer e ao resfriar.
| A parte interna da casca da laranja é rica em pectina |
Emulsão
Nessa dispersão coloidal o dispergente e o disperso se encontram na fase líquida, primariamente separados por serem substâncias apolares e imiscíveis entre sí, necessitam de uma outra substância para se interagirem.
Podemos exemplificar esse tipo de transformação da seguinte forma: a água que é polar, mais óleo que é apolar não se misturam. No entanto ao associarmos a água e óleo, o detergente que possui uma de suas extremidades polar, ocorre a homogeneização formando a emulsão.
Isso acontece porque o detergente comporta-se como sal, possui uma das extremidades polar positiva que entra em contato com a parte polar negativa da molécula de água, se juntam numa massa capaz de neutralizar a gordura.
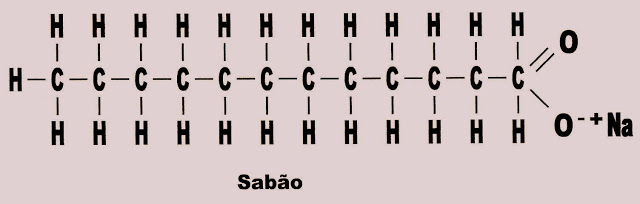
Observe abaixo a forma estrutural plana de uma molécula de sabão.
?
Observe abaixo a forma estrutural plana de uma molécula de sabão.
?
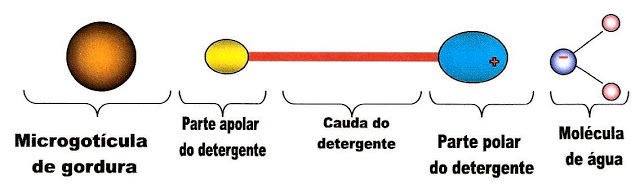
 |
| Esquema de uma molécula de sabão ou detergente. Observe a parte polar numa das extremidades. |
 |
| A figura representa a mesma molécula de detergente acima com a parte polar, cauda e parte apolar. |
?O esquema abaixo representa a microgotícula de óleo ou gordura, a molécula do detergente ou sabão com sua cauda, a parte apolar, a parte polar, e a molécula de água.

?
??? Como o detergente tira o óleo da sua mão?
Você já derramou óleo de cozinha nas suas mãos e passou água nela? Você vê que o óleo continua impregnado. No entanto ao passar sabão, sabonete ou detergente e esfregar; cria-se uma pasta (emulsão) que ao lavar é totalmente retirada pela água.
Você já derramou óleo de cozinha nas suas mãos e passou água nela? Você vê que o óleo continua impregnado. No entanto ao passar sabão, sabonete ou detergente e esfregar; cria-se uma pasta (emulsão) que ao lavar é totalmente retirada pela água.
????
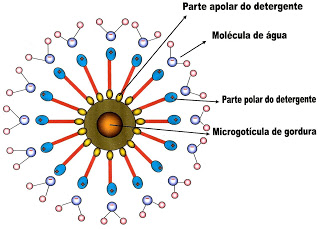 |
| A figura representa a água o detergente e a microgotícula de gordura apolar, cercada pela parte apolar do detergente |
A Ação do Detergente ou Sabão e Água Sobre o Óleo
Como mostra a figura acima, na extremidade da cadeia carbônica do detergente, na parte polar está a carboxila (COO?), o oxigênio dessa carboxila de carga negativa, ?segura? o sódio ionizado (Na+) que permanece ligado ao detergente dando a configuração final positiva a essa parte da molécula. Por sua vez o sódio com a sua carga positiva, atrai a molécula de água que possui um dos polos negativo, desse modo juntam-se a água e o detergente. No entanto ao atrair a molécula de água, esta possui ligação intermolecular entre elas mais forte que a ligação intermolecular das moléculas de óleo por isso continuam unidas em ?blocos de moléculas de água?sem se desfazerem e estes pressionam (no ato mecânico de esfregar as mãos com sabão) as macrogotas de gordura que se rompem em suas ligações intermoleculares, formando microgotículas ou bolinhas microscópicas de gordura que se dispersam. Essas microgotas por não terem saída, pressionadas pela massa de água e detergente unidas por suas extremidades polarizadas, ?são empurradas para a parte neutra, indo se alojar na parte apolar, ou seja; na cauda do detergente ou sabão. Como as moléculas do detergente permanecem unidas á massa de água pelas suas partes polares, todas elas se voltam num rearranjo com a parte apolar ou a cauda voltada para uma única direção contrária, formando um circulo apolar, (figura acima) tendo no seu centro a gotícula sem polaridade da gordura, que fica presa nesse local. Ao lavar (as mãos ) com água, esta remove totalmente; tanto o detergente como a gotícula de gordura presa a ele.
Como São Separados os Constituintes Das Dispersões Coloidais
A observação dos colóides das dispersões é feita por ultramicroscópios.
A separação é feita por:
Ultrafiltragem ? utilização de ultrafiltros.
Ultracentrifugação ? centrífugas com 60.000 rpm (rpm = rotações por minuto).
Diálise.
Eletroforese.
Diálise
Diálise é o processo de separação de impurezas ou produtos tóxicos solúveis num dispergente.
O sangue é um a dispersão coloidal com um nível de colóides estabilizado pelo organismo e em geral pelos rins.
A Hemodiálise e o Sangue
O Que é o Sangue? Componentes do Sangue.
Primeiramente deveremos ter uma visão geral da função e composição do sangue para defini-lo como uma dispersão coloidal.
O metabolismo celular é o conjunto de reações químicas, de síntese de novos componentes, de remoção de células mortas, ou dos seus restos celulares dessa degradação a nível celular, de aproveitamento dos nutrientes levados pelo sangue até esses locais e após cumprirem suas funções, geram substâncias tóxicas que retornam para a circulação sanguínea e devem ser eliminadas pelo organismo, através da filtração do sangue.
Os componentes do sangue ou do plasma sanguíneo são: os glóbulos vermelhos (hemácias), glóbulos brancos (leucócitos) e plaquetas. Esses componentes não são colóides por possuir o tamanho acima do especificado para um colóide. No entanto há outros componentes do sangue, que são os gasosos; gás oxigênio (O2), gás carbônico (CO2), eletrólitos; Na+,K+, Ca2+,Mg2+, Cl?, HCO31?, SO42?sais minerais, não eletrólitos; glicose, aminoácidos, proteínas, enzimas, hormônios, uréia, creatinina, lactato, lipídios, etc.
Alimentos Que Proporcionam o Aumento de Alguns Desses Eletrólitos no Organismo
O Fósforo, Potássio e o Sal na Dieta Alimentar e Sua Concentração Plasmática
Alimentos Que Proporcionam o Aumento de Alguns Desses Eletrólitos no Organismo
O Fósforo, Potássio e o Sal na Dieta Alimentar e Sua Concentração Plasmática
O Fósforo principalmente na forma de fosfatos é essencial ao organismo humano e normalmente temos uma concentração balanceada no plasma sanguíneo.
Todo ser humano deve ter uma dieta balanceada a base de nutrientes que contenham esse eletrólito devido ser necessários ao organismo. Os alimentos que contém proporções maiores desse elemento químico são: a carne bovina, de frango, de peixe, ele aparece nos queijos, no leite, nos iogurtes, na carne de porco, em ovos, no feijão, na ervilha, nas lentilhas, no grão-de-bico, na soja, na sardinha, linguiça, fígado, salsicha, e outros alimentos como o amendoim, a castanha de cajú, as nozes, avelãs, e também no refrigerante coca-cola, e na cerveja.
O potássio também muito necessário ao nosso organismo entra pela ingestão de alimentos ricos nesse eletrólito. Ele está presente principalmente em frutas como o abacate, a banana, o açaí, a uva, a mexerica, nectarina, na jaca, na goiaba, mamão, maracujá, kiwi, damasco, graviola, no figo e no melão, tomate, no extrato de tomate, em frutas secas como a ameixa e o damasco, em legumes como o feijão, grão-de-bico soja, nas verduras agrião, almeirão, escarola, o repolho, da família das solanáceas o pimentão, da família dos tubérculos a cenoura, da família das Cucurbitaceae o pepino, da família das betuláceas a avelã, da família das castanhas as nozes. Também aparece no chocolate, no caldo de cana e no sal light.
O sal é outro eletrólito muito solicitado pelo organismo na forma do cátion sódio Na+, aparece em grandes quantidades nos embutidos como o presunto, está presente na mortadela, no bacon, na linguíça, nos salames, em salsichas, no molho de mostarda, nos catchups, nos molhos de soja, nos cubos de temperos a base de caldo de carne ou de galinha, em sopas e salgadinhos.
Com o aumento da ingestão desses alimentos ocorre o aumento, principalmente do fósforo, do potássio e do sal no nosso organismo. Consequentemente ocorre o controle de seu nível plasmático pela função excretora renal num indivíduo que tenha os rins funcionando normalmente.
A Água e os Pacientes Com Deficiência Renal Crônica Severa
Pacientes com deficiência renal crônica séria, que perdeu por exemplo, 90% de sua capacidade de filtração, devem tomar uma quantidade de água bem restrita e indicada pelo médico. Se um paciente normal urinar 2 litros por dia ele pode tomar água normalmente. Porém se o rim de um paciente não filtrar a água ingerida haverá o acumulo no organismo, que levará a outros problemas com mesmo grau de seriedade.
Os Medicamentos e os Pacientes Com Deficiência Renal Crônica Severa
Os pacientes que se servem normalmente da diálise não devem tomar nenhum tipo de medicamento sem o acompanhamento médico.
Patologias Que Podem Influenciar o Nível Das Substâncias Plasmáticas
Os rins podem sofrer parada de funcionamento por alguns dias e depois voltar a funcionar normalmente por exemplo:, numa infecção renal aguda, pelas toxinas de medicamentos, ou de alguns tipos de contrastes que o indivíduo toma, e até mesmo numa hipertrofia prostática. Nesse caso não haverá problemas mais sérios para o paciente que volta a ter a funcionalidade renal e a vida normal.
Outro problema é o déficit cardíaco, quando o coração não tem força suficiente para bombear o sangue, que não chega com a pressão suficiente por volta de 70 a 80 mmHg necessária para que haja a filtração pelos rins. Problemas também acontecem numa hemólise quando é liberada grande quantidade de hemoglobina na circulação e ocorre danos nos túbulos renais.
Outros problemas que comprometem a função renal são a hipertensão arterial, rim policístico, cálculo renais, o diabetes todos esses podem causar danos aos rins
As patologias mais sérias que perduram e podem impedir a filtração do sangue pelos rins são a glomerulonefrite, nefrose ,nefropatias, essas é que levam a insuficiência renal aguda (IRA) ou insuficiência renal crônica, que por sua vez pode ser chamada de oligúria ou anúria irreversível o que caracteriza respectivamente a diminuição ou parada da produção da urina. Essa perda da função renal, causa o aumento das substâncias tóxicas dissolvidas no plasma sanguíneo.
A insuficiência renal com a perda de capacidade entre 50 até 75% são controláveis por dietas, menor ingestão de alimentos de água etc. No entanto quando a perda da capacidade de funcionamento renal atinge 90% por períodos prolongados sendo irreversível suas condições fisiológicas. Nesse caso se o paciente estiver de certa forma saudável, é aí que se entra com a diálise.
Períodos Que o Paciente Passa a frequentar as Seções de Hemodiálise
O Sistema renal filtra o nosso sangue continuamente, porem o rim artificial filtrará o sangue apenas por algumas horas por dia; 4 horas diárias, por dias intercalados da semana, segundo especialistas pelo menos 12 horas semanais divididas em sessões devem ser feitas, mas isso já equivale a uma condição de vida praticamente bem aceitável em termos de normalidade.
| Sala de hemodiálise com os seus respectivos aparelhos |
O Processo da Diálise
Aparelho de uso somente em clínica especializada de hemodiálise.
Contra Indicação Para a Hemodiálise
Pacientes com hipercalemia, ou seja; com o aumento excessivo de potássio (K+) no plasma sanguíneo, ou com hipocalemia que é a baixa desse eletrólito plasmático e também aqueles que apresentam anomalias de coagulação sanguínea incontroláveis, esses não devem realizar a hemodiálise.
Efeitos Indesejáveis
No decorrer do processo da remoção artificial de impurezas do sangue, pode ocorrer em certos pacientes desconfortos como náuseas e hipotensão arterial.
A Máquina e o Campo Magnético
A máquina funciona com um potencial elétrico consideravelmente forte, o que possibilita a formação de um campo magnético ao seu redor. Por isso objetos receptores de ondas eletromagnéticas, intercomunicadores sonoros, ou aparelhos eletrônicos como o rádio, televisão, celulares são capazes de interferirem ou sofrer interferência.
Hemodiálise ? A Química Presente
Antes de se começar uma diálise, é necessário efetuar a lavagem e desinfecção química e térmica do aparelho, usando água aquecida e especialmente tratada para esse fim.
Os Líquidos Utilizados no Dialisador
Existem dois recipientes acoplados á máquina com líquidos concentrados, um com o concentrado de bicarbonato e outro com o concentrado ácido (ou acetato do vinagre). Existe ainda a introdução da água tratada por osmose reversa.
A preparação do Dialisante
Para que haja o ajuste iônico é necessário misturar o concentrado de bicarbonato com o concentrado ácido (ou acetato) e a água.
O ajuste é feito através de bombeamento (bombas) cada substância está separada uma da outra e seguem cada uma por seu tubo próprio, em proporções certas de bicarbonato, do ácido e da água até se encontrarem e se misturarem e seguirem por um tubo plástico único.
Em seguida a mistura passa por uma outra bomba de desgaseificação para retirar bolhas de ar que porventura são formadas no processo. Daí prosseguem pelo tubo único até o dialisador. Todo esse processo é o da preparação do dialisante que contém: sódio (Na+), potássio (K+), cálcio (Ca++), magnésio (Mg++), cloro (Cl-), e acetato. Em seguida esse líquido dialisante é ajustado ou calibrado por bombas para a pressão compatível com a do sistema vascular humano e com o seu equilíbrio iônico correto.
Estando pronto para iniciar a operação da diálise é necessário uma verificação da pressão das bombas, ou do líquido dialisador e a calibração das pressões do liquido dialisador e do sangue que passa pela máquina.
O Filtro ? O Dialisador
Para utilização dos filtros ou dialisadores, as embalagens não devem estar violadas. Existem vários tipos e modelos de dialisadores, alguns deles são descartáveis e outros podem ser reaproveitáveis. Segue-se desse modo as normas de limpeza desses filtros reutilizáveis.
Com tudo pronto para o início, conecta-se um tubo na artéria do paciente com a máquina, que no nosso caso é o modelo 4008H/S.
| A figura mostra o dialisador conectado á máquina |
A Dialização
O sangue flui para o tubo do aparelho e segue para o interior da máquina, onde é heparinizado (anticoagulante) por uma bomba de heparina e segue até o dialisador. O sangue chega até o dialisador que está acoplado á máquina, aí também se encontra o dialisante, que passa por tubos porosos paralelos ao do sangue.
O sangue circula pela serpentina na mesma pressão que a do líquido dialisante, entrando em contato com esse líquido por intermédio de poros de membrana que só deixam passar as substâncias tóxicas, os cátions ânions e colóides em excesso. Em alta concentração do lado do sangue, essas substâncias difundem pelos poros de membrana para o líquido de diálise de baixa concentração.
O líquido dialisador carregado com o excesso de ânions, cátions, colóides e outras substâncias tóxicas retirados do sangue, sai do dialisador e vai para o descarte.
O sangue purificado vai para a câmara de gotas venosa.
No final o sangue que saiu do dialisador, chega á câmara de gotas, método com o qual se evita bolhas de ar no sangue que volta para o paciente, reentrando via sistema venoso.
Terminada toda a operação, o sangue restante do aparelho deverá ser reintroduzido no paciente.
Bibliografia
Manual de operações Software, 4,5 M . 395871. Para máquina de hemodiálise 4008S.
Martha Reis - Completamente Química: físico-química - Volume 2, capítulo 2. Editora FTD ? São Paulo: 2001
Avaliação de Dispersões Coloidais
1) Podemos definir a palavra colóide e dispersão coloidal como:
a) a partícula dispersa; que significa goma ou cola. Dispersão coloidal não é uma solução verdadeira e também não se qualifica como mistura heterogênea.
b) aglomerados componentes das dispersões coloidais que se juntam em dispersantes de macromoléculas ou macro íons com o diâmetro de dimensões entre 10 a 1000 angstrons. Esses aglomerados não podem ser observados a olho nú.
c) a partícula dispersa; que significa goma ou cola. Dispersão coloidal é uma solução verdadeira e também se qualifica, como mistura heterogênea.
d) a partícula dispersa; que significa goma ou cola. Dispersão coloidal não é uma solução verdadeira, mas se qualifica como mistura homogênea.
e) a partícula dispersante; que significa goma ou cola. Dispersão coloidal é uma solução verdadeira e também se qualifica, como mistura saturada.
2) Em relação aos colóides e suas dimensões podemos dizer que:
a) os colóides são os componentes das dispersões coloidais que se aglomeram em dispersões de macromoléculas ou macroíons com o diâmetro de dimensões entre 10 a 1000 cm . Esses dispersantes podem ser observados a olho nú.
b) os colóides são os componentes das dispersões coloidais que se dispersam em agregados de macromoléculas ou macro íons com o diâmetro de dimensões entre 10 a 1000 mm . Esses aglomerados podem ser observados a olho nú.
c) os colóides são os componentes das dispersões coloidais que se juntam em agregados de macromoléculas ou macro íons com o diâmetro de dimensões entre 0,1 a 0,001 angstrons. Esses aglomerados podem ser observados a olho nú.
d) os colóides são os componentes das dispersões coloidais que se juntam em agregados de macromoléculas ou macro íons com o diâmetro de dimensões entre 10 a 1000 angstrons. Esses aglomerados não podem ser observados a olho nú.
e) os colóides são os componentes dos dispergentes coloidais que se juntam em agregados de micromoléculas ou micro íons com o diâmetro de dimensões entre 1 a 1000 angstrons. Esses aglomerados não podem ser observados a olho nú.
3) A respeito de dispersante e disperso podemos afirmar:
a) Numa dispersão coloidal deve existir o disperso. Ao misturarmos maisena (amido de milho) com água, teremos uma dispersão coloidal. O dispergente é a maisena e a água.
b) Numa dispersão coloidal deve existir o disperso e o dispersante. Ao misturarmos maisena (amido de milho) com água, teremos uma dispersão coloidal. O dispergente é a maisena e o dispersante a água.
c) Numa solução coloidal deve existir o disperso e o dispersante. Ao misturarmos maisena (amido de milho) com água, teremos uma solução coloidal. O dispergente e o dispersante é a maisena.
d) os colóides são os componentes das dispersões coloidais que se juntam em agregados de macromoléculas ou macro íons com o diâmetro de dimensões entre 10 a 1000 ângstrons. Esses aglomerados não podem ser observados a olho nú.
e) Dispersante e disperso podem ser definidos como materiais particulado naturais ou não suspenso num gás em movimento contínuo.
4) Geralmente as partículas pequenas se juntam para formarem o colóide (macromolécula) por ligações intermoleculares. Por sua vez os colóides formados possuem a sua carga elétrica própria.
a) A carga elétrica do disperso é diferente para todas as partículas do meio, porque é essa carga elétrica que manterá esses colóides juntos uns dos outros criando a repulsão ou dispersão.
b) Numa dispersão coloidal deve existir o disperso e o dispersante. Ao misturarmos maisena (amido de milho) com água, teremos uma dispersão coloidal. O dispergente é a maisena e o dispersante a água.
c) A carga elétrica do disperso é igual para todas as partículas do meio, porque é essa carga elétrica que manterá esses colóides equidistantes uns dos outros criando a repulsão ou dispersão.
d) A carga elétrica do dispergente é igual para todas as partículas do meio, porque é essa carga elétrica que manterá esses colóides equidistantes uns dos outros criando a aproximação.
e) A carga elétrica do disperso e dispergente é igual para todas as partículas do meio, porque é essa carga elétrica que manterá esses colóides emparelhados uns com os outros criando a repulsão ou dispersão.
5) Aerosol pode ser definido como material particulado natural ou não suspenso num gás em movimento contínuo. Assinale a alternativa correta.
a) No aerosol sólido, nesse tipo de dispersão coloidal o dispergente está na forma sólida e o disperso está na forma gasosa. Um tipo aerosol sólido são as micropartículas de poeira dispersas no ar.
b) No aerosol sólido, nesse tipo de dispersão coloidal o dispergente está na forma gasosa e o disperso está na forma sólida. Um tipo aerosol sólido são as micropartículas de poeira dispersas no ar.
c) No aerosol sólido, nesse tipo de dispersão coloidal o dispergente e o disperso estão na forma gasosa. Um tipo aerosol sólido são as micropartículas de poeira dispersas no ar.
d) É uma dispersão coloidal em que o dispergente está na fase líquida e o disperso está na fase gasosa.
e) No aerosol sólido, nesse tipo de dispersão coloidal o dispergente está tanto na fase gasosa quanto na forma líquida e o disperso está na forma sólida. Um tipo aerosol sólido são as micropartículas de poeira dispersas no ar.
6) Aerosol líquido pode ser definido como material particulado natural ou não suspenso num gás em movimento contínuo. Assinale a alternativa correta.
a) Nessa dispersão coloidal o dispergente e o disperso se encontram na fase líquida, primariamente separados por serem substâncias apolares e imiscíveis entre sí, necessitam de uma outra substância para se interagirem.
b) Nesse tipo de Dispersão, o dispergente está na fase gasosa e o disperso está na fase líquida. Um bom exemplo desse tipo de dispersão é a neblina em que o disperso está na fase líquida e o dispersante na fase gasosa.
c) Nesse tipo de Dispersão, o dispergente está na fase sólida e o disperso está na fase líquida. Um bom exemplo desse tipo de dispersão é a neblina em que o disperso está na fase líquida e o dispersante na fase gasosa.
d) Nesse tipo de Dispersão, o dispergente está na fase gasosa e o disperso está na fase sólida. Um bom exemplo desse tipo de dispersão é a neblina em que o disperso está na fase líquida e o dispersante na fase gasosa.
e) Nessa dispersão coloidal o dispergente e o disperso se encontram na fase sólida, primariamente separados por serem substâncias iônicas e miscíveis entre sí, necessitam de uma outra substância para se interagirem.
7) Para retirar o óleo de uma superfície impregnada usamos sabão. A ação do sabão é de ?quebrar? as ligações intermoleculares das gotas de óleo e reduzi-las a microgotículas que são depois isoladas pelas mesmas moléculas do sabão e depois retiradas com água no ato de lavagem.
a) Essa dispersão coloidal é uma emulsão.
b) Essa dispersão coloidal é um aerosol líquido.
c) Essa dispersão coloidal é um gel.
d) Essa dispersão coloidal é um sol ou hidrosol.
e) Essa dispersão é um sol sólido.
8) Com relação ao estado físico de um gel podemos afirmar que:
a) Os géis são as geleias, tipo; geleias de pêssego, geleias de laranja, de amoras. Gel é um tipo de dispersão coloidal em que o dispergente está na fase gasosa.
b) Essa dispersão coloidal se comporta como um aerosol líquido.
c) nessa dispersão coloidal tanto o dispergente como o disperso está na fase sólida.
d) Essa dispersão coloidal é um sol ou hidrosol.
e) Os géis são as geleias, tipo; de pêssego, de laranja, de amoras. Gel é um tipo de dispersão coloidal em que o dispergente está na fase sólida.
9) Com relação ao estado físico de um gel podemos afirmar que:
a) Os géis são dispersões em que tanto o dispergente a água como os disperso a proteína pectina se apresentam na fase líquida.
b) Os géis são dispersões em que tanto o dispergente a água como os disperso a proteína pectina se apresentam na fase sólida.
c) O disperso está na fase líquida. Nesse caso a água é o disperso na pectina.
d) Essa dispersão coloidal é um sol ou hidrossol, porque a albumina substância albuminóide é a gelatina formadora do gel.
e) A gelatina que nos preparamos em casa como sobremesa nas refeições é uma substância que pertence ao grupo gel, porque o dispergente se encontra na fase líquida e o disperso na fase sólida.
10) Podemos explicar substâncias no estado sol como:
a) os géis são dispersões em que tanto o dispergente a água como os disperso o polissacarídio pectina se apresentam na fase líquida.
b) gelatinas industrializadas as quais tem capacidade de atrair água e se transformar em pasta. Nesse caso o dispergente é a água que está na fase líquida e o disperso o pó da gelatina na fase sólida.
c) o disperso está na fase líquida. Nesse caso a água é o disperso na pectina.
d) Essa dispersão coloidal é um sol ou hidrosol porque o dispergente se encontra na fase líquida e o disperso na fase sólida.
e) A gelatina que nos preparamos em casa como sobremesa nas refeições é uma substância que pertence ao grupo gel, porque o dispergente se encontra na fase líquida e o disperso na fase sólida.
11) Podemos dizer que entre os componentes do sangue estão os:
a) géis que são as dispersões em que tanto o dispergente o plasma como os dispersos se apresentam na fase líquida.
b) eletrólitos as hemácias que são os glóbulos vermelhos, os leucócitos as células brancas de defesa do organismo que são os glóbulos brancos e as plaquetas que atuam no processo de fechamento de rupturas de vasos sanguíneos.
c) não eletrólitos, que são os compostos inorgânicos os quais são: os ácidos, as bases, os sais e os óxidos.
d) não eletrólitos: a glicose, os aminoácidos, as proteínas, as enzimas, os hormônios, a uréia, creatinina, lactato, lipídios, etc.
e) compostos da albumina que nos preparamos em casa como sobremesa nas refeições é uma substância que pertence ao grupo gel, porque o dispergente se encontra na fase líquida e o disperso na fase sólida.
loading...
- Olhando Mais A Fundo Para As Moléculas Dos Sabões...
Os sabões são detergentes (palavra que deriva da palavra latina detergere que significa limpar) pois têm como papel limpar a sujidade não solúvel em água dos tecidos, metais, corpo... mas os sabões são uma classe particular de detergentes. Os...
- Outro Sangue Ii
No artigo anterior desta série, vimos que os perfluorocarbonetos (PFC) são substâncias que possuem um enorme potencial de aplicação em formulações usadas como substitutos do sangue na função de transporte de oxigénio. São estruturalmente semelhantes...
- Dispersões: Colóides, Suspensões E Soluções - Resumo
Dispersões: Colóides, suspensões e soluções Uma dispersão é formada por pelo menos um disperso (soluto) e um dispergente (solvente). Dispersões são sistemas em que o soluto sólido está espalhado uniformemente em toda a mistura. A classificação...
- Atividade De Recuperação De Estudos - Soluções - Atividade N° 01
É hora de exercícios! Nesta atividade os alunos devem observar os conteúdos estudados em sala como: SolubilidadeA solubilidade varia com a temperatura.A solubilidade de alguns solutos aumenta com o aumento da temperatura.A temperatura é um fator...
- Avaliação De Química N° 3 - Soluções
Avaliação de Química Geral1) Calcule a concentração, em g/L e g/ml, de uma solução de nitrato de potássio, sabendo que ela possui 60g do sal em 300 cm3 de solução. 2) (Mackenzie-SP) Qual a concentração, em g/L da solução obtida ao se dissolverem...
