Química
Bolsista: Eliana Carvalho


- Já Pensou Transformar Uma Madeixa Do Seu Cabelo Num Diamante?
Um artigo publicado no mês de Setembro no jornal Expresso referia o facto de ser possível transformar cabelo em diamantes. Uma possibilidade de guardar e usar átomos de carbono que fizeram parte do organismo de entes queridos. Parece quase mentira......
- Carbono (c)
Bolsista:Ricardo Paraguai Estou aqui mais uma vez para trazer-lhes uma matéria bem interessante, que vai nutrir a fome de conhecimento que eu e todos os bolsistas do blog sabemos que vocês têm.Bem, essa semana na nossa coluna ?CineQuímica? falaremos...
- Preciosidade Do Diamante
Bolsista: Roniel FranciscoOlá seguidores do QUIPIDID, hoje atualizamos nossa coluna de atualidades com uma matéria do portal G1, que foi exibida dia 03/10/13 no jornal hoje, e fala sobre um diamante rosa de 60 quilates (12 gramas), que será...
- Planeta ?terra? Pode Ter Descoberto O Planeta ?diamante?
Bolsista: Alessandro R. Barbosa Oi seguidores e amigos do QUIPIBID! Hoje atualizamos nossa coluna de atualidades com uma reportagem do portal G1, sobre um estudo sugere descoberta de um...
- Brasileiros Buscam Novas Técnicas Para Produzir Diamantes
Reator para deposição de diamante CVD e nanotubos de carbono, no laboratório Dimare, da Unicamp. [Imagem: INPE/DIMARE] Deposição de vapor químico Evaldo José Corat, pesquisador do Instituto Nacional de Pesquisas Espaciais (Inpe), está chefiando...
Química
Diamantes
Bolsista: Eliana Carvalho


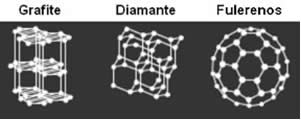
O diamante é uma das formas alotrópicas (pode se unir de várias formas diferentes, formando inúmeras substancias) do carbono, que também pode se apresentar na forma pura como: grafite, carvão e fulereno. Em compostos, ele pode ser encontrado em carbonatos, hidrocarbonetos, carbetos, etc.

A forma alotrópica do carbono é a substância natural mais dura existente no mundo. A dureza do diamante é devido sua estrutura altamente compacta, mas mesmo sendo duro o diamante pode ser quebrado mas não riscado. Além de um ótimo isolante elétrico, pois seus elétrons de valência estão firmemente envolvidos na formação de ligação sigma entre os átomos de carbono, não sobrando elétrons livres para conduzir corrente elétrica. Para saber a quantidade de átomos de carbono que há em certa quantidade de brilhantes é necessário consultar a tabela periódica para chegar ao valor da massa. Como o átomo é muito pequeno a unidade de media usado para medi-lo será U.
Vejamos um exemplo:
Para saber a quantidade de átomos que há em um diamante que contenha 0,4g.c. Admitindo-se que um diamante contenha apenas átomos de carbono.
A massa atômica dele na tabela é 12,0
Então vamos calcular?
12u C ------------- 6.1023
0.4u C-------------X
X= 2.1022 átomos de C
Que bom, amigos Quipibid sabermos que através da química podemos fazer quem não tem brilho tornar a jóia mais brilhosa do mundo.
Referências bibliográficas
http://letras.mus.br/damares/1785921/
http://www.brasilescola.com/quimica/alotropia-carbono.htm
http://antoniodantasnet.blogspot.com.br/2006/12/qumica-diamantes.html
http://www.webluxo.com.br/menu/joias/11/diamante-amarelo-110-quilates.htm
http://www.diamantes.noradar.com/
Peruzzo, Francisco Miragaia Química na abordagem do cotidiano vol 1/ Francisco Miragaia Peruzzo (Tito), Eduardo Leite do Canto. - 4. Ed.- São Paulo: Moderna, 2006, pag 478-484.
loading...
- Já Pensou Transformar Uma Madeixa Do Seu Cabelo Num Diamante?
Um artigo publicado no mês de Setembro no jornal Expresso referia o facto de ser possível transformar cabelo em diamantes. Uma possibilidade de guardar e usar átomos de carbono que fizeram parte do organismo de entes queridos. Parece quase mentira......
- Carbono (c)
Bolsista:Ricardo Paraguai Estou aqui mais uma vez para trazer-lhes uma matéria bem interessante, que vai nutrir a fome de conhecimento que eu e todos os bolsistas do blog sabemos que vocês têm.Bem, essa semana na nossa coluna ?CineQuímica? falaremos...
- Preciosidade Do Diamante
Bolsista: Roniel FranciscoOlá seguidores do QUIPIDID, hoje atualizamos nossa coluna de atualidades com uma matéria do portal G1, que foi exibida dia 03/10/13 no jornal hoje, e fala sobre um diamante rosa de 60 quilates (12 gramas), que será...
- Planeta ?terra? Pode Ter Descoberto O Planeta ?diamante?
Bolsista: Alessandro R. Barbosa Oi seguidores e amigos do QUIPIBID! Hoje atualizamos nossa coluna de atualidades com uma reportagem do portal G1, sobre um estudo sugere descoberta de um...
- Brasileiros Buscam Novas Técnicas Para Produzir Diamantes
Reator para deposição de diamante CVD e nanotubos de carbono, no laboratório Dimare, da Unicamp. [Imagem: INPE/DIMARE] Deposição de vapor químico Evaldo José Corat, pesquisador do Instituto Nacional de Pesquisas Espaciais (Inpe), está chefiando...
