Química

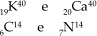
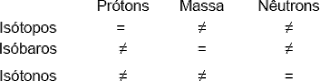
- Avaliação Sobre O Estudo Do Átomo
Avaliação Sobre: A Massa, Volume e a Densidade do Átomo Para as primeiras séries A, B, C, 1TA,1TB. ...
- Dominó Dos Elementos Químicos
Bolsista:Paula Xavier Vasconcelos Olá pessoal, a dica desta semana é o jogo de dominó. O objetivo do jogo é abordar os elementos químicos da tabela periódica, memorizando os símbolos, nomes e massas e números atômicos de cada respectivo elemento....
- Modelos Atômicos
Bolsista: Litton Jr. Olá seguidores do QUIPIBID! Hoje a nossa dica de vestibular para vocês é sobre os modelos atômicos. As origens da Química são muito antigas. Por volta do ano 400 a.C., surgem os primeiros conceitos teóricos da Química.Demócrito...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
- Avaliação N° 1 - Estrutura Atômica
QUESTÕES: 1) Descubra o número de atômico e o número de massa do átomo de cloro, sabendo que ele tem dezessete prótons e dezoito nêutrons.a) número atômico 17 e massa 30b) número atômico 18 e massa 35c) número atômico 17 e massa 35d) número...
Química
Isótopos, Isóbaros e Isótonos
Bolsista: Litton Jr.
Olá amigos do QUIPIBID! Essa semana na nossa coluna de dicas de vestibular iremos falar sobre os isótonos, isóbaros e isótonos, o conteúdo é curto e de facil compreensão, mas para isso é necessário entender algumas características do átomo. Então vamos lá!!
A descoberta dos isótopos:
J.J. Thomson observou que gases quimicamente puros apresentam valores distintos para a relação carga/massa e que para um mesmo gás essa relação é constante.
Aperfeiçoando as técnicas de medição, Thomson observou um fato notável: o neônio, um gás de massa 20,2, comportava-se como uma mistura de gases de massas 20 e 22, pois apareciam desvios diferentes no tubo de descargas. Como a carga do neônio é constante, Thomson deduziu que esse gás quimicamente puro é constituído por átomos de mesma carga, porém de massa diferentes.
Em 1919, o cientista inglês Francis Willian Aston (1877-1945) aperfeiçoou a aparelhagem de Thomson, de quem foi discípulo, inventando o primeiro espetrógrafo de massa. Com esse aparelho, Aston demonstrou com maior clareza a existência de átomos de um mesmo elemento, com massas diferentes, deixando claro o fato de o neônio ser formado de átomos quimicamente iguais, porém com massas diferentes. Tais formas de um elemento foram denominadas pelo cientista inglês Frederick Soddy (1877-1956) de isótopos, do grego iso = mesmo; topos = lugar.
Isótopos:
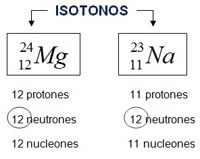
Isotopia é o fenômeno segundo o qual átomos de diferentes números de massa constituem o mesmo elemento químico.
Assim sendo, dizemos que: Isótopos são átomos de um mesmo elemento que apresentam o mesmo numero atômico e diferentes números de massa.
O nome do isótopo é dado pelo nome do elemento a que pertence, seguido do respectivo número de massa.

Isóbaros:
Isobaria é o fenômeno segundo o qual átomos diferentes apresentam o mesmo numero de massa.
Assim dizemos que: Isóbaros são átomos de elementos distintos que apresentam o mesmo numero de massa e diferentes números atômicos
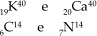
Isótonos:
Isotonia é o fenômeno segundo o qual átomos diferentes tem o mesmo numero de nêutrons.
Assim dizemos que: Isótonos são átomos de elementos químicos distintos que apresentam diferentes números atômicos, diferentes números de massa e mesmo numero de nêutrons.

Conclusão
Conclui-se que os átomos isóbaros são os átomos de diferentes elementos químicos, porém massa igual. Isótopos são do mesmo elemento químico, porém tem numero de massa diferente. Isótonos são de diferentes elementos químicos e diferente numero de massa, mas tem número de nêutrons iguais.
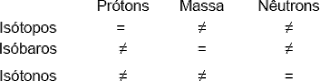
Bom pessoa, espero que tenha ficado claro o conteúdo, qualquer duvida ou sugestões podem deixa comentários na matéria, até semana que bem bom estudos para todos vocês!!!
?
loading...
- Avaliação Sobre O Estudo Do Átomo
Avaliação Sobre: A Massa, Volume e a Densidade do Átomo Para as primeiras séries A, B, C, 1TA,1TB. ...
- Dominó Dos Elementos Químicos
Bolsista:Paula Xavier Vasconcelos Olá pessoal, a dica desta semana é o jogo de dominó. O objetivo do jogo é abordar os elementos químicos da tabela periódica, memorizando os símbolos, nomes e massas e números atômicos de cada respectivo elemento....
- Modelos Atômicos
Bolsista: Litton Jr. Olá seguidores do QUIPIBID! Hoje a nossa dica de vestibular para vocês é sobre os modelos atômicos. As origens da Química são muito antigas. Por volta do ano 400 a.C., surgem os primeiros conceitos teóricos da Química.Demócrito...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
- Avaliação N° 1 - Estrutura Atômica
QUESTÕES: 1) Descubra o número de atômico e o número de massa do átomo de cloro, sabendo que ele tem dezessete prótons e dezoito nêutrons.a) número atômico 17 e massa 30b) número atômico 18 e massa 35c) número atômico 17 e massa 35d) número...
