Química
- O Ibuprofeno: Um Fármaco Com Sucesso
O Ibuprofeno é um fármaco do grupo dos anti-inflamatórios não esteróides (do sub-grupo químico dos derivados do ácido propanóico), fármacos que têm em comum a capacidade de combater a inflamação, a dor e a febre. Tal como os outros anti-inflamatórios...
- Número De Partículas
Número de Partículas Constante de Avogadro Foi Amadeu Avogadro, Italiano que em 1811 propôs pela primeira vez um valor numérico constante que em determinada pressão e temperatura, coincidiria com o número de moléculas...
- ?celobar?
Bolsista:...
- Sobre O Omeprazol...
...
- Propriedades Químicas Dos Alcoóis
Os compostos pertencentes a esta função química são muito reativos, devido a presença da hidroxila ou oxidrila. O hidrogênio confere um leve caráter ácido ao grupo oxidrila, sendo, portanto mais reativos que os hidrocarbonetos, devido a polaridade...
Química
O MEDICAMENTO MAIS UTILIZADO NO MUNDO
Bolsista: Karliene

Olá pessoal! Hoje vou mostrar para vocês a reação química do medicamento mais utilizado nas ultimas décadas: o ácido acetilsalicílico.
Aspirina, doril, melhoral são os nomes mais populares do ácido acetilsalicílico, medicamento classificado como anti-inflamatório, antipirético e analgésico. O principio ativo da aspirina vem da casca do salgueiro onde são extraídos a salicina e o salicilato.
A utilização deste medicamento teve inicio na Mesopotâmia há 3 mil anos a.C. contra cefaléia. No século XIX já se usava o ácido salicílico e os pacientes reclamavam de irritação estomacal crônica, causada pela acidez do medicamento. A partir desta data, o químico Félix Hoffmam passou a pesquisar um derivado menos ácido e, em 1898, obteve o ácido acetilsalicílico. Este era mais efetivo e mais tolerável ao organismo. O medicamento começou a ser então comercializado em 1899 pela Bayer. Em seu estado puro é solúvel em éter e álcool, e insolúvel em água.
As principais utilizações do medicamento são para os tratamentos de febres, dores de cabeça, trombose e diabetes.
Este medicamento é contraindicado nos casos de: úlcera, anemia, gastrite, gota, lúpus, asma e suspeita de dengue; pois, neste último, ele pode elevar o quadro de hemorragia.
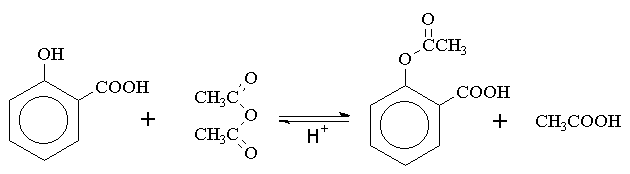
Síntese do Acido Acetilsalicílico
Neste processo o acido salicílico (1) é tratado com anidrido acético (2) e um pouco de acido sulfúrico, catalisador, conforme pode ser observado na reação abaixo:

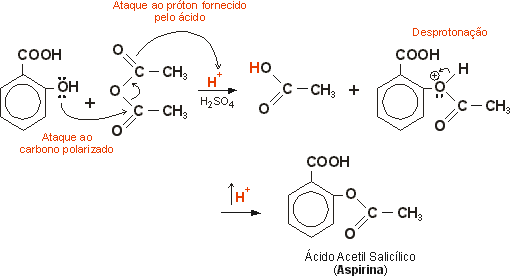
Noções sobre mecanismo de reação:

A segunda reação mostra o mecanismo envolvido na formação da aspirina. O ácido sulfúrico protona um dos oxigênios do anidrido acético, que ao romper a ligação dupla, forma um carbocátion terciário. Para estabilizá-lo, o oxigênio da hidroxila presente no ácido salicílico doa um par de elétrons para a ligação C-O. Nesta etapa ocorre o rompimento da ligação O-H e o oxigênio fica com o par de elétrons desta ligação, possibilitando a formação do ácido acetilsalicílico.
O Aas, como é popularmente chamado, não é recomendado para crianças menores de 18 anos devido ao pequeno risco de síndrome de Reye, uma doença muitas vezes fatal causando danos cerebrais. No adulto raramente provoca danos permanentes.
Ótima semana a todos e em breve estaremos com mais um novo medicamento.
Referência:
Tito e Canto. Química Orgânica vol. 3. 4ª Edição. 2008.
loading...
- O Ibuprofeno: Um Fármaco Com Sucesso
O Ibuprofeno é um fármaco do grupo dos anti-inflamatórios não esteróides (do sub-grupo químico dos derivados do ácido propanóico), fármacos que têm em comum a capacidade de combater a inflamação, a dor e a febre. Tal como os outros anti-inflamatórios...
- Número De Partículas
Número de Partículas Constante de Avogadro Foi Amadeu Avogadro, Italiano que em 1811 propôs pela primeira vez um valor numérico constante que em determinada pressão e temperatura, coincidiria com o número de moléculas...
- ?celobar?
Bolsista:...
- Sobre O Omeprazol...
...
- Propriedades Químicas Dos Alcoóis
Os compostos pertencentes a esta função química são muito reativos, devido a presença da hidroxila ou oxidrila. O hidrogênio confere um leve caráter ácido ao grupo oxidrila, sendo, portanto mais reativos que os hidrocarbonetos, devido a polaridade...
