Química

A Definição Para os Óxidos
- A Química Na Poluição
Bolsista: Luzia Morais dos SantosOlá amigos seguidores do blog quipibid, tudo bem com vocês! Nestas férias continuamos com as postagens de novas matérias para que nosso conhecimento e aprendizagem não adormeçam. Hoje discutiremos como a química...
- Batman
Bolsista: Mônika Cristina Hoje iremos falar de um clássico americano, o primeiro filme do Batman, ele é um super-herói conhecido como homem-morcego, personagem de histórias em quadrinhos...
- Carbono(c)
Bolsista: Leonice ParaguaiOi pessoal! Mais uma vez, estou de volta para falar de mais um ?Elemento Químico?. Hoje vou falar um pouco do Carbono (C) um elemento de grande importância para os seres vivos. Conhecido pelo homem pré-histórico sob as formas...
- Gás Do Riso Ou Hilariante
É um gás incolor, composto de duas partes de nitrogênio e uma de oxigênio, cuja fórmula química é N2O e sua fórmula estrutural é N?N?O. Por muito tempo foi conhecido como gás hilariante ou gás do riso, pela capacidade que possui de provocar...
- O Produto Da Queima Dos Combustíveis Fósseis
Em um motor de combustão, um combustível de hidrocarboneto é oxidado pelo oxigênio atmosférico. Em condições ideais, somente o dióxido de carbono, água e calor seria gerado: No entanto, sob as condições do motor a combustão ideal é...
Química
Oxidos
A Definição Para os Óxidos
Óxido são substâncias formadas pelo elemento químico oxigênio que é o mais eletronegativo presente em sua estrutura molecular e qualquer outro elemento químico que seja diferente do flúor, pois o flúor possui a sua eletronegatividade maior que a do oxigênio. Os óxidos podem ser caracterizados como as ferrugens.
Os Exemplos de Alguns Dos Óxidos Mais Comuns
CO - monóxido de carbono |
CO2 - dióxido de carbono ? gás carbônico |
NO2 - dióxido de mononitrogênio |
N2O - monóxido de dinitrogênio |
N2O5 - pentóxido de dinitrogênio |
CaO - óxido de cálcio |
Li2O - óxido de lítio |
Pb3O4 - tetróxido de trichumbo - zarcão |
CaCO3 - carbonato de cálcio |
Al2O3 - óxido de alumínio - bauxita |
MnO3 - trióxido de manganês |
Fe3O4 - tretóxido de triferro - magnetita |
Fe2O3 - óxido férrico - hematita |
CuO - óxido cúprico - óxido de cobre II |
Cu2O - óxido cuproso ? óxido de cobre I |
SO2 - dióxido de enxofre |
SO3 - trióxido de enxofre |
ZnO - óxido de zinco |
MgO - óxido de magnésio |
CaO - óxido de cálcio |
Na2O - óxido de sódio |
K2O - óxido de potássio |
Cr2O3 - óxido de cromo III |
Mn2O7 - heptóxido de dimanganês |
ou óxido de manganês VII |
SrO - óxido de estrôncio |
SnO - óxido de estanho |
P2O5 - pentóxido de difosforo |
N2O3 - trióxido de dinitrogênio |
Cl2O - óxido de dicloro |
HgO - óxido de mercúrio |
A Ocorrência Dos Óxidos na Natureza
Os óxidos aparecem abundantemente na natureza na forma de água (a água é um óxido), de ferrugens, de minerais como o quartzo, a hematita, a pirosulita, cassiterita, bauxita, magnetita entre outros e na forma de gases lançados na atmosfera.
A poluição por determinados tipos de óxidos gasosos pode advir de indústrias e veículos automotores que utilizam combustíveis fósseis para a geração de energia, especialmente quando se usa combustíveis de baixa qualidade como a gasolina ruim que interfere no rendimento dos motores, provém de queimadas de florestas, campos, pastagens, da queima da cana-de-açúcar na hora de ser colhida.
A poluição por veículos automotores e pelas indústrias pode ser controlada pelo uso de combustíveis de boa qualidade, por filtros e catalisadores que reduzem a quantidade de determinados gases nocivos lançados na atmosfera e consequentemente no meio ambiente de um modo geral.
Os Óxidos e a Poluição Pelo Ser Humano
Monóxido de Carbono (CO)
Provem da queima incompleta de combustíveis, é um gás extremamente tóxico, poluente atmosférico, pode ter origem dos escapamentos dos veículos automotores sem catalisadores de onde é liberado para a atmosfera. No corpo humano esse gás tem 250 vezes mais afinidade pela hemoglobina que o oxigênio
O Monóxido de Carbono no Corpo Humano
Dióxido de carbono (CO2)
Monóxido de Carbono (CO)
Provem da queima incompleta de combustíveis, é um gás extremamente tóxico, poluente atmosférico, pode ter origem dos escapamentos dos veículos automotores sem catalisadores de onde é liberado para a atmosfera. No corpo humano esse gás tem 250 vezes mais afinidade pela hemoglobina que o oxigênio
O Monóxido de Carbono no Corpo Humano
O monóxido de carbono não tem cheiro, cor, sabor, e é altamente tóxico e letal.
O organismo humano também produz o monóxido de carbono naturalmente em quantidades pequeníssimas. Nessas ínfimas proporções, ele desempenha um papel como sinalizador fisiológico para o corpo como neurotransmissor ou como um relaxante dos vasos sanguíneos.
No entanto, como o monóxido de carbono atua no nosso organismo, algumas vezes beneficiando, outras vezes; a apresentação de anormalidades metabólicas tem sido consideradas ligadas à sua presença. Há uma variedade de doenças que podem ser consideradas como causadas pelo monóxido de carbono, as quais são: neuro-degenerações, hipertensão, falência cardíaca e inflamações.
Também é de pleno conhecimento, que no sistema sanguíneo humano, nos eritrócitos, combina-se irreversivelmente com a hemoglobina produzindo a carboxihemoglobina e a faz perder a capacidade de levar oxigênio para os tecidos do nosso corpo. Admite-se que concentrações de 667 ppm (seiscentas e sessenta e sete partículas para cada milhão) pode causar a conversão de 50% da hemoglobina do sangue em carboxihemoglobina e causar falência desse sistema, coma e morte.
É produzido em grandes quantidades na época das queimadas da cana-de-açúcar, atualmente as queimadas da cana de açúcar vem aos poucos sendo abandonadas pelo uso de maquinarias de colheita de alta tecnologia. Esse gás também é produzido nos incêndios florestais, na queima de combustíveis pelos veículos automotores, pode originar das fuligens de chaminés. Uma das consequências do aumento do CO2 atmosférico é a formação da chuva ácida.
O Monóxido de Mononitrogênio (NO)
O monóxido de nitrogênio (NO) é formado nas "descargas" de relâmpagos ou raios, as moléculas do gás oxigênio e nitrogênio são cindidas ao meio, cada átomo; de oxigênio e nitrogênio atômico se une individualmente formando o gás NO. O monóxido de nitrogênio formado em contato com o oxigênio do ar reage imediatamente com o oxigênio (O2) e forma o NO2 e o ozônio (O3). O NO, também é formado nas erupções vulcânicas, é um dos responsáveis pela destruição da camada de ozônio da atmosfera.
A reação de formação do NO pode ser representada:
N2 + O2 -------- 2 NO
O Monóxido de Dinitrogênio (N2O) - Gás Hilariante
Esse gás é obtido a partir do nitrato de amônia por aquecimento, gerando o óxido de dinitrogênio, não é toxico, no ser humano produz excitação histérica, como vontades de cantar, rir brigar, o uso prolongado leva a inconsciência, entretanto em medicina pode ser usado como anestésico.
Dióxido de Enxofre (SO2)
orígem vulcões ativos, relâmpagos, indústrias que queimam combustíveis fósseis, é prejudicial à saúde humana cardio respiratório irritante para as mucosas, é anti-séptico, livre na atmosfera forma o gás trióxido de enxofre, é prejudicial para as plantas com relação a fotossíntese, necrose e sensibilidade aos parasitas.
trióxido de Enxofre (SO3)
é formado a partir do dióxido de enxofre, vulcões ativos, forma chuva ácida, incorporado ao solo forma SO4 pelas sulfobactérias.



Os Peróxidos
O monóxido de nitrogênio (NO) é formado nas "descargas" de relâmpagos ou raios, as moléculas do gás oxigênio e nitrogênio são cindidas ao meio, cada átomo; de oxigênio e nitrogênio atômico se une individualmente formando o gás NO. O monóxido de nitrogênio formado em contato com o oxigênio do ar reage imediatamente com o oxigênio (O2) e forma o NO2 e o ozônio (O3). O NO, também é formado nas erupções vulcânicas, é um dos responsáveis pela destruição da camada de ozônio da atmosfera.
A reação de formação do NO pode ser representada:
N2 + O2 -------- 2 NO
O Monóxido de Dinitrogênio (N2O) - Gás Hilariante
Esse gás é obtido a partir do nitrato de amônia por aquecimento, gerando o óxido de dinitrogênio, não é toxico, no ser humano produz excitação histérica, como vontades de cantar, rir brigar, o uso prolongado leva a inconsciência, entretanto em medicina pode ser usado como anestésico.
Dióxido de Enxofre (SO2)
orígem vulcões ativos, relâmpagos, indústrias que queimam combustíveis fósseis, é prejudicial à saúde humana cardio respiratório irritante para as mucosas, é anti-séptico, livre na atmosfera forma o gás trióxido de enxofre, é prejudicial para as plantas com relação a fotossíntese, necrose e sensibilidade aos parasitas.
trióxido de Enxofre (SO3)
é formado a partir do dióxido de enxofre, vulcões ativos, forma chuva ácida, incorporado ao solo forma SO4 pelas sulfobactérias.
A Classificação Dos Óxidos
Óxidos Neutros ou Moleculares
A característica própria dos ácidos neutros é que, quando em contato com água, ácidos ou bases, eles não reagem. O seu comportamento é assim devido ao fato de sua estrutura molecular ser constituída por ligações do tipo covalente molecular simples e dativa.
Observe as estruturas desses óxidos.
CO (monóxido de carbono)

Na ligações covalentes do monóxido de carbono há duas ligações covalentes molecular simples (dois traços) e uma ligação covalente dativa (flecha).
NO (monóxido de nitrogênio ou óxido nítrico)

Na ligação do monóxido de nitrogênio há duas ligações covalentes molecular simples (dois traços).
Óxido nitroso ou gás hilariante (gás do riso) e anestésico.

De acordo com a regra do octeto, o óxido nitroso forma uma ligação covalente simples e uma ligação covalente dativa nos dois nitrogênios e duas ligações covalentes moleculares simples no nitrogênio com oxigênio.
?
Óxidos Ácidos
Os óxidos ácidos são formados a partir da desidratação de um ácido, portanto são anidridos. Possuem por característica própria, a estruturação molecular formada por ligações covalentes entre o oxigênio participante e outro elemento químico ametal de alta eletronegatividade. Ao reagirem com água formam ácido e ao reagirem com uma base formam sais e água. São essas propriedades que lhes possibilitam o atributo de serem óxidos ácidos.
Alguns exemplos de óxidos ácidos
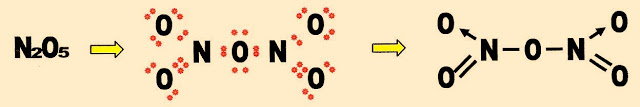
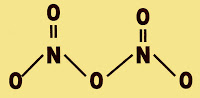
Pentóxido de dinitrogênio


O pentóxido de dinitrogênio é um oxidante instável, ao misturar com componentes orgânicos e sais de amônia, forma composto fortemente explosivo. Ao se decompor forma o gás dióxido de nitrogênio altamente tóxico.
Os Peróxidos
Os Superóxidos
A Nomenclatura Dos Óxidos
Bibliografia
Geraldo Camargo de Carvalho - Química Moderna. Volume 1. Ed. Scipione, 3ª edição. P. 229 a 256.
Tito e Canto - Química na Abordagem do Cotidiano. Volume 1. Ed. Moderna, 2ª edição. P. 270 a 302.
Ricardo Feltre - Química Geral. Volume 1. Ed. Moderna, 6ª edição. P. 218 a 236.
Dinitrogen pentoxide - Wikipedia, the free encyclopedia
en.wikipedia.org/wiki/Dinitrogen_pentoxideEm cache - Similares
Dinitrogen pentoxide - Wikipedia, the free encyclopedia
en.wikipedia.org/wiki/Dinitrogen_pentoxideEm cache - Similares
loading...
- A Química Na Poluição
Bolsista: Luzia Morais dos SantosOlá amigos seguidores do blog quipibid, tudo bem com vocês! Nestas férias continuamos com as postagens de novas matérias para que nosso conhecimento e aprendizagem não adormeçam. Hoje discutiremos como a química...
- Batman
Bolsista: Mônika Cristina Hoje iremos falar de um clássico americano, o primeiro filme do Batman, ele é um super-herói conhecido como homem-morcego, personagem de histórias em quadrinhos...
- Carbono(c)
Bolsista: Leonice ParaguaiOi pessoal! Mais uma vez, estou de volta para falar de mais um ?Elemento Químico?. Hoje vou falar um pouco do Carbono (C) um elemento de grande importância para os seres vivos. Conhecido pelo homem pré-histórico sob as formas...
- Gás Do Riso Ou Hilariante
É um gás incolor, composto de duas partes de nitrogênio e uma de oxigênio, cuja fórmula química é N2O e sua fórmula estrutural é N?N?O. Por muito tempo foi conhecido como gás hilariante ou gás do riso, pela capacidade que possui de provocar...
- O Produto Da Queima Dos Combustíveis Fósseis
Em um motor de combustão, um combustível de hidrocarboneto é oxidado pelo oxigênio atmosférico. Em condições ideais, somente o dióxido de carbono, água e calor seria gerado: No entanto, sob as condições do motor a combustão ideal é...
