Química
3) Um estudante desejando conhecer melhor sobre variação ebulioscópica, preparou uma solução aquosa de glicose com 100 g do soluto. Sabendo que a constante ebulioscópica da água pura é 0,52 ºC molal/L, ele deseja saber a concentração molal, a elevação do ponto de ebulição e a temperatura que a solução entra em ebulição. O que deve ser feito para se chegar ao que ele deseja?
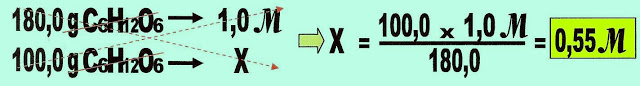
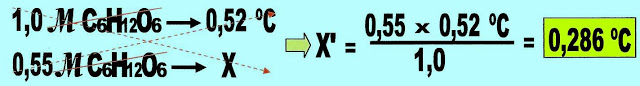
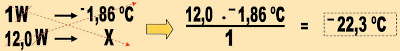
?tc = variação da temperatura criogênica
tc = temperatura criogênica




Osmose
Um fenômeno interessante acontece na agricultura arrozeira, na planície Costeira do Sul do Brasil. Ali ocorre uma perda elevada na colheita dos grãos devido a irrigação. Esse fato acontece porque a água de irrigação do local contém uma quantidade de sais elevada, e com as sucessivas irrigações, esse sal vai se acumulando no solo que passa a ter uma concentração muito alta, mais alta que os sais do interior das células dessas plantas. Como as plantas necessitam de muita água para o seu ciclo vital, elas retiram a água do solo por osmose, que é a passagem do menos concentrado para o mais concentrado. No entanto, nesses solos o processo é reverso, o solo contendo uma concentração de sal maior que o das plantas, retém a água, as células das raízes das plantas contendo uma concentração de sais menor, não tem força de absorção suficiente para embeber seus tecidos, nesse caso, ocorre o fenômeno de seca fisiológica da planta e da plantação de arroz quebrando a produção agrícola, favorecendo a esterilização do solo.
Questões
Tonoscopia ? Wikipédia, a enciclopédia livre
- Questões Sobre Transformações Químicas
Primeiro bimestre ? Avaliação 1ª Séries A; B; C; TA; TB. 1) O mineral com o qual se produz a cal virgem ou hidratada, que é empregado na construção civil é: a) NaCO3 - carbonato de sódio. b)...
- A QuÍmica Em Favor Do Tempo E Economia!
Bolsista: Gisléia Chaves Olá amigos do Quipibid! Hoje iremos destacar um instrumento usado pelas donas de casa em favor do tempo e economia na arte de cozinhar. Este instrumento irá...
- O Que A Química Tem Haver Com Cozinhar Alimentos???
Voluntária: Nara Alinne N. da Silva O que é o certo quando vamos cozinhar verduras, frutas ou legumes: Cozinhar com sal ou sem sal? O ideal é que cozinhemos...
- Concentração De Soluções
bolsista: Litton Jr. Olá amigos do QUIPIBID! A matéria dessa semana da nossa coluna dicas de vestibular, vamos falar sobre um assunto bem cobrado nas provas de vestibulares. Estamos falando de concentração de soluções, como...
- Atividade De Recuperação De Estudos - Soluções - Atividade N° 01
É hora de exercícios! Nesta atividade os alunos devem observar os conteúdos estudados em sala como: SolubilidadeA solubilidade varia com a temperatura.A solubilidade de alguns solutos aumenta com o aumento da temperatura.A temperatura é um fator...
Química
Propriedades Coligativas
Propriedades Coligativas
Definição
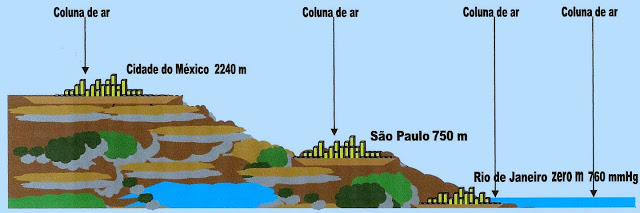
A Altitude a Pressão Atmosférica e o Ponto de Ebulição
O que influencia diretamente nas propriedades coligativas é a altitude, que se relaciona diretamente com a pressão atmosférica. Podemos tomar como exemplo o ponto de ebulição da água, que se torna mais baixo e ferve muito mais rápido em altitudes elevadas. Porém, nesse caso; ao cozinharmos um alimento, a água de cozimento entra em ebulição muito mais rapidamente e em temperatura mais baixa, portanto; o tempo de cozimento do alimento no ponto certo é muito mais prolongado. Como já sabemos, a altitude da superfície terrestre influencia a pressão atmosférica sobre superfícies e com isso o ponto de ebulição dos líquidos. Por exemplo, a fervura da água potável na cidade do México acontece em temperatura mais baixa que na cidade de São Paulo, que ferve em temperatura mais baixa que na cidade do Rio de Janeiro.
Pressão de Vapor de um Líquido

Propriedades coligativas são as propriedades que os solutos proporcionam ao serem adicionados em solventes, na formação de soluções líquidas com características que são próprias. Essas substâncias quando adicionadas, mudam o comportamento físico dessas substâncias que tem as suas propriedades físicas bem regulares. As propriedades que são desreguladas são, a temperatura de congelamento, fusão, ebulição e difusão.
São Propriedades Coligativas
A tonoscopia, ebulioscopia, crioscopia, osmose e difusão.
Na observação dos fenômenos das propriedades coligativas, deve-se levar em consideração a altitude local, a pressão atmosférica exercida sobre a superfície da localidade, do líquido em experimento, para obtenção dos dados das transformações.
A Altitude a Pressão Atmosférica e o Ponto de Ebulição

A Altitude e a Oxigenação Celular
Com o aumento da altitude topográfica, ocorre a diminuição da concentração parcial dos gases atmosférico, por exemplo; do oxigênio (O2), do nitrogênio (N2) etc, necessários especialmente para a respiração biológica em geral.
A Evaporação
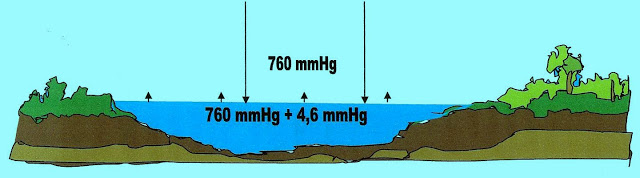
A evaporação é um fenômeno que acontece em Condições Normais, em líquidos em geral e também é óbvio com a água. Com a água se pudéssemos ver a olho nú veríamos sobre a sua superfície uma camada de moléculas no estado gasoso num frenesi de choques, tentando vencer a força gravitacional contrária a sua força de pressão máxima de vapor.
Supondo que esta seja pura ou potável as moléculas da superfície, tendo uma pressão máxima de vapor acima da pressão atmosférica, devido a concentração de suas partículas, e do movimento e choques delas umas contra as outras, criam uma pressão interna desse meio que consegue vencer a força da pressão atmosférica exercida sobre si e evapora.
Supondo que esta seja pura ou potável as moléculas da superfície, tendo uma pressão máxima de vapor acima da pressão atmosférica, devido a concentração de suas partículas, e do movimento e choques delas umas contra as outras, criam uma pressão interna desse meio que consegue vencer a força da pressão atmosférica exercida sobre si e evapora.
A água líquida, por exemplo; a zero grau Celsius tem uma pressão máxima de vapor em torno de 4,6 mmHg. Isso significa que a essa temperatura as moléculas de sua superfície consegue romper a pressão atmosférica de sua superfície.

A movimentação das partículas ou moléculas de água "cria" a pressão máxima de vapor.

Para que o fenômeno físico acima aconteça são necessárias as Condições, sejam Normais ou não.
As Condições Normais são:
P = 760 mmHg.
T = zero grau Celsius.
Altitude = zero metro.
Pressão máxima de vapor = 760 mmHg + 4,6 mmHg = 764,6 mmHg.
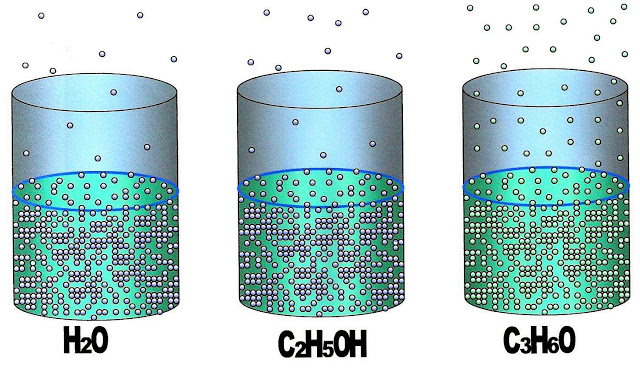
Pressão Máxima de Vapor de Substâncias Diferentes
Aqui é representada a pressão máxima de vapor (PMV) em ambiente aberto, de três substâncias diferentes; água álcool etílico e acetona. A temperatura, a massa e a pressão atmosférica são as mesmas, mudando somente a PMV de cada uma delas.


Das três substâncias a que possui maior PMV é a acetona (mais volátil), a que tem menor PMV é a água (menos volátil), a que evapora mais rápida é a acetona, a água é a que demora mais para evaporar.
Abaixamento da Pressão Máxima de Vapor
Tonoscopia
Tonoscopia
A tonoscopia é o estudo do abaixamento da pressão máxima de vapor de um líquido, quando é adicionado um soluto não volátil. A temperatura de ebulição da solução varia, conforme a quantidade de soluto adicionada.
No entanto a pressão de vapor do líquido deve estar equilibrada antes do fenômeno de mudança pela adição do soluto.
TonometriaNo entanto a pressão de vapor do líquido deve estar equilibrada antes do fenômeno de mudança pela adição do soluto.
A tonometria trata os cálculos quantitativos envolvidos nos fenômenos físicos de transformações que ocorrem na tonoscopia.
Exemplos:
Exemplos:
1) Uma solução de fração molar igual a 0,02 em sacarose, foi aquecida até 100 ºC. Pergunta-se: qual é o abaixamento da pressão máxima de vapor dessa solução e qual é a pressão final da solução?
Dados considerados para a resolução do problema:
- pressão máxima de vapor da água pura a 100 ºC = 760 mmHg.
- H2O + sacarose = solução 0,02 molar.
- H2O + sacarose = solução 0,02 molar.
No exercício, o que acontece é a diminuição da pressão máxima de vapor da água pura quando se adiciona sacarose.
Resolução

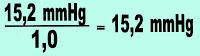
Resolução

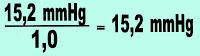
Como o abaixamento da pressão máxima de vapor foi de 15,2 mmHg, qual é a pressão máxima de vapor agora?

Resolução
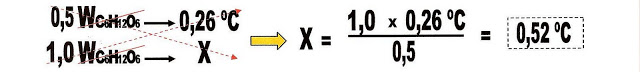
Como a temperatura de ebulição da solução é a soma da temperatura inicial do solvente puro (H2O = 100 ºC) mais a temperatura com o solvente e o soluto.
100 ºC + 0,52 ºC = 100,52 ºC.
A solução entrará em ebulição a 100,52 graus Celsius.
Resolva o restante dos ítens abaixo.
b) 1,0 molal de C6H12O6.

A pressão final é de 744,8 mmHg.
Ebulição - Ebulioscopia - Cálculo
Em Condições Normais H2O pura a zero metro de altitude, 760 mmHg de pressão, a temperatura de ebulição (Te) é 100ºC.
A Te (temperatura de ebulição) em CN (Condições Normais)
A Te da H2O pura + 0,5 molal de glicose (C6H12O6) = 100,26ºC.
Também sabe-se, que dobrando o número de partículas de soluto dissolvidas na solução dobra-se a constante ebuliométrica do solvente. Aqui no nosso caso a H2O é o solvente.
1) Considerando que a temperatura de ebulição das soluções aumentam conforme o número de partículas de soluto não volátil dissolvidas, a 760 mmHg de pressão. Qual a temperatura de ebulição das seguintes soluções de glicose com as seguintes concentrações?
a) 0,5 molal de C6H12O6.
Considerando a letra W = molalidade.
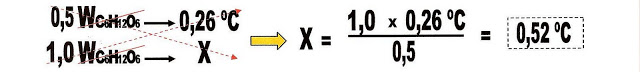
Como a temperatura de ebulição da solução é a soma da temperatura inicial do solvente puro (H2O = 100 ºC) mais a temperatura com o solvente e o soluto.
100 ºC + 0,52 ºC = 100,52 ºC.
A solução entrará em ebulição a 100,52 graus Celsius.
Resolva o restante dos ítens abaixo.
b) 1,0 molal de C6H12O6.
c) 1,25 molal de C6H12O6.
d) 1,5 molal de C6H12O6.
e) 1,75 molal de C6H12O6.
f) 2,0 molal de C6H12O6.
Esses cálculos deve levar em conta, o ponto máximo de dissolução do soluto no solvente.
2) Em condições normais, qual a temperatura de ebulição das soluções de sacarose (C12H22O11) com as seguintes concentrações.
a) 190 g
b) 220 g
c) 280 g
d) 300 g
e) 350 g
f) 400 g
g) 650 g
A Constante Ebuliométrica Dos Líquidos
Cada substância líquida tem sua própria constante ebuliométrica (Ke). Essa constante é a temperatura do solvente que se eleva quando um mol de soluto não volátil é diluído em um quilograma da solução.
A equação da constante ebuliométrica apresentada logo abaixo é usada nos cálculos de ebuliometria está relacionada com:
R - que é a constante universal dos gases = 8,314 J/K . 1 mol = 2 cal/K . 1 mol.

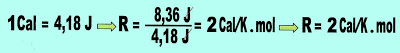
A equação da constante ebuliométrica apresentada logo abaixo é usada nos cálculos de ebuliometria está relacionada com:
R - que é a constante universal dos gases = 8,314 J/K . 1 mol = 2 cal/K . 1 mol.

Para acharmos o valor de R em calorias usamos a equação:
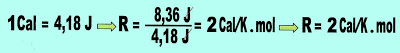
Lv = Calor latente de vaporização sem mudança de temperatura de um quilograma de solvente liquido. Obs: esse dado deve ser obtido por análise laboratorial antecipadamente para que sirva propositalmente, no nosso caso.
Te = temperatura de ebulição do solvente.
Te = temperatura de ebulição do solvente.
A partir dos dados acima, podemos calcular a constante ebuliométrica de algumas substâncias.
a) Cálculo da constante ebuliométrica da água.
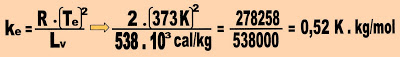
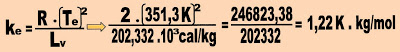
a) Cálculo da constante ebuliométrica da água.
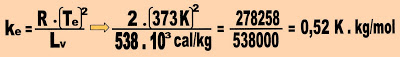
0,52K . kg/mol = 0,52 ºC . kg/mol = 0,52 ºC/ molal.
b) Calcular a constante ebuliométrica do álcool.
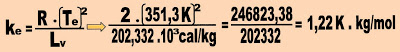
1,22 K . kg/ mol = 1,22 ºC . kg/mol = 1,22 ºC/molal.
Adaptado ? Química ? Ricardo Feltre, vol. 2, 6ª edição, p. 74. Exercício 21.
Temperatura de ebulição = 77,0 ºC (sob pressão normal).
Calor latente de vaporização = = 46 cal/g.
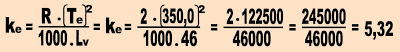

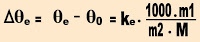

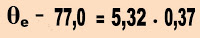

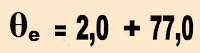
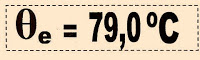
2) Supondo que cem gramas de uma substância de massa molecular 266, foram dissolvidos em 1000 g de tetracloreto de carbono (CCl4). Qual a temperatura de ebulição da solução, sob pressão normal?
Dados relativos ao tetracloreto de carbono puro:Temperatura de ebulição = 77,0 ºC (sob pressão normal).
Calor latente de vaporização = = 46 cal/g.
Dados referentes á resolução do exercício.
Te = 77,0 + 273 = 350 K.
R = 2.
m1 = 100g.
m2 = 1000g.
M = 266 g.
T0 = 77,0 ºC.
ke = para calcular.
Te = 77,0 + 273 = 350 K.
R = 2.
m1 = 100g.
m2 = 1000g.
M = 266 g.
T0 = 77,0 ºC.
ke = para calcular.
??e ou ?e = ?
Primeiramente calculamos a constante ebuliométrica do tetracloreto de carbono.
Primeiramente calculamos a constante ebuliométrica do tetracloreto de carbono.
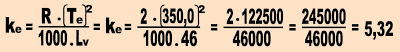

Calculando a temperatura de ebulição.
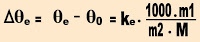

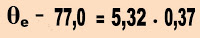

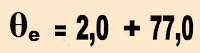
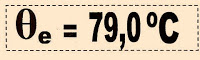
3) Um estudante desejando conhecer melhor sobre variação ebulioscópica, preparou uma solução aquosa de glicose com 100 g do soluto. Sabendo que a constante ebulioscópica da água pura é 0,52 ºC molal/L, ele deseja saber a concentração molal, a elevação do ponto de ebulição e a temperatura que a solução entra em ebulição. O que deve ser feito para se chegar ao que ele deseja?
Achamos a massa do soluto
C6H12O6 = (6 x 12) + (1 x 12) + (6 x 16) = 72 + 12 + 96 = 180 g
Preparamos a solução
100 g de glicose + 900 mL água = 1000 mL de solução.
Calculamos a molalidade da solução.
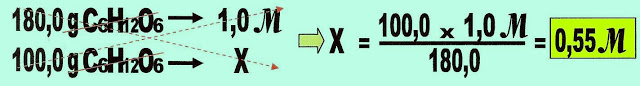
Calculamos a elevação da temperatura de ebulição.
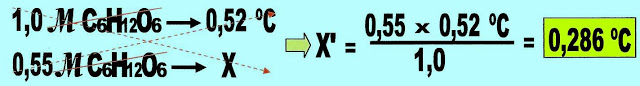
Calculamos a temperatura que a solução entra em ebulição.
100 ºC + 0,286 ºC = 100,286 ºC.
Crioscopia
A crioscopia é o abaixamento da temperatura de congelamento de uma solução, quando se adiciona um soluto não volátil ao solvente líquido puro.
A crioscopia está diretamente relacionada à proporção do soluto adicionado ao solvente.
Denomina-se Kc = a constante de abaixamento da temperatura de congelamento.
Comprova-se experimentalmente que o Kc da água corresponde a 1,86 ºC.
Portanto, o Kc = 1000 g H2O + 1 mol de um soluto não volátil, que forma uma solução um molal (W), corresponderá ao abaixamento da temperatura de congelamento = a 1,86 ºC.
Observe alguns exemplos:
Kc de 1000 g de H2O + 1 mol de sacarose (C12H22O11) = 342,0 g do açúcar corresponderá a 1 molal = 1,86 ºC, de abaixamento da temperatura de congelamento da solução.
Kc = 1000 g de H2O + 1 mol de sacarose (C12H22O11) = 342,0 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de cloreto de sódio (NaCl) = 58,5 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de glicose (C6H12O6) = 180,0 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de etilenoglicol (C2H6O2) = 62,0 g = 1 molal = 1,86 ºC.
Observe alguns exemplos:
Kc de 1000 g de H2O + 1 mol de sacarose (C12H22O11) = 342,0 g do açúcar corresponderá a 1 molal = 1,86 ºC, de abaixamento da temperatura de congelamento da solução.
Kc = 1000 g de H2O + 1 mol de sacarose (C12H22O11) = 342,0 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de cloreto de sódio (NaCl) = 58,5 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de glicose (C6H12O6) = 180,0 g = 1 molal = 1,86 ºC.
Kc = 1000 g H2O + 1 mol de etilenoglicol (C2H6O2) = 62,0 g = 1 molal = 1,86 ºC.
A H2O + 342,0 g de C12H22O11, congela a ?1,86 ºC.
A H2O + 62,0 g de C2H6O2, congela a ?1,86 ºC.
Observa-se que a água pura congela a zero grau Celsius e 1 atmosfera de pressão. A água mais um mol de qualquer soluto não volátil congela a zero grau Celsius, acrescido de 1,86 graus negativos.
Observa-se que a água pura congela a zero grau Celsius e 1 atmosfera de pressão. A água mais um mol de qualquer soluto não volátil congela a zero grau Celsius, acrescido de 1,86 graus negativos.
Exercícios

1) O etilenoglicol (C2H6O2) de densidade = 1,12 g/cm³, é usado como anticongelante em radiadores de automóveis, foi usado numa mistura, na proporção de 4 L, com 6 L de água, cuja densidade é de 1,0 g/cm³. Calcule a molalidade do etilenoglicol e o ponto de congelamento da solução final.
Dados:
Etilenoglicol sendo adicionado ao radiador do carro. Atualmente o etilenoglicol é usado concentrado sem ser diluído em água, para evitar corrosão, ou oxidação de partes do motor.
1) O etilenoglicol (C2H6O2) de densidade = 1,12 g/cm³, é usado como anticongelante em radiadores de automóveis, foi usado numa mistura, na proporção de 4 L, com 6 L de água, cuja densidade é de 1,0 g/cm³. Calcule a molalidade do etilenoglicol e o ponto de congelamento da solução final.
Dados:
Massa C2H6O2 = (2 x 12) + (6 x 1) + (16 x 2) = 24 + 6 + 32 = 62,0 g
M = 62,0 g
d = 1,12 g/cm³
m1 = d x V = 1,12 g/mL x 4000 mL = 4480,0 g
KcH2O = 1,86 ºC
a) cálculo da molalidade da solução.


m2 = 6 L = 6000 mL = 6000 gH2O
W = Molalidade
Com os dados acima, podemos usar então a equação:
a) cálculo da molalidade da solução.


b) Se:
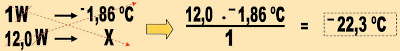
Ou posso chegar ao mesmo resultado pela fórmula:
?tc = variação da temperatura criogênica




Exercício adaptado do livro: Tito e Canto - Química Na abordagem do Cotidiano, vol. 2, físico-química. Editora Moderna, primeira edição, p 71.
Osmose e osmoscopia é a difusão espontânea do solvente por uma membrana semipermeável, (permeabilidade seletiva), a qual deixa passar o íon Na+ que carrega consigo, e no entanto impede a glicose (C6H12O6) de passar, do menos concentrado para o mais concentrado. A passagem acontece porque o solvente possui maior pressão de vapor. Essa difusão ocorre até que ocorra o equilíbrio ou igualdade de concentração em ambos os lados.
Onde Ocorre Osmose
A salada de alface murcha porque a água flui do interior das células do vegetal para o tempero do lado externo, que está mais concentrado com sal e vinagre.
A osmose nas plantas ocorre com os íons do solo, proporcionalmente menos concentrados, mas sob maior pressão de vapor (umidade da água, solvente), são absorvidos juntamente com a água, passam pelas membranas celulares, daí para o interior das raízes, região mais densa, local mais concentrado de arranjos moleculares e outros compostos, carregando consigo por exemplo; o composto iônico uréia CO(NH2)2, do solo, até finalmente alcançar a seiva e se distribuir para todo o sistema da planta. Verificando dados.
A Pressão Osmótica ? Inverso da Osmose
A pressão osmótica é o inverso da osmose, porque se trata da pressão osmótica igual ou minimamente superior exercida contrária ao fluxo, partindo do lado de maior concentração de soluto (s) para o menos concentrado que é o solvente.
Exemplo de Pressão Osmótica
Exemplo de Pressão Osmótica
Um fenômeno interessante acontece na agricultura arrozeira, na planície Costeira do Sul do Brasil. Ali ocorre uma perda elevada na colheita dos grãos devido a irrigação. Esse fato acontece porque a água de irrigação do local contém uma quantidade de sais elevada, e com as sucessivas irrigações, esse sal vai se acumulando no solo que passa a ter uma concentração muito alta, mais alta que os sais do interior das células dessas plantas. Como as plantas necessitam de muita água para o seu ciclo vital, elas retiram a água do solo por osmose, que é a passagem do menos concentrado para o mais concentrado. No entanto, nesses solos o processo é reverso, o solo contendo uma concentração de sal maior que o das plantas, retém a água, as células das raízes das plantas contendo uma concentração de sais menor, não tem força de absorção suficiente para embeber seus tecidos, nesse caso, ocorre o fenômeno de seca fisiológica da planta e da plantação de arroz quebrando a produção agrícola, favorecendo a esterilização do solo.
Assinale somente a alternativa correta
1) Podemos definir propriedades coligativas como:
a) a presença de um reagente em uma solução, que não depende do número de suas partículas dispersas nessa solução e nem da dependência da natureza do soluto.
b) uma solução com a presença de um ou mais solutos, que depende do número de suas partículas dissociadas ou íons dispersos na solução, não dependendo, no entanto, da natureza do soluto.
c) a presença de um líquido em uma solução e não depende do número de suas partículas agregadas nessa solução e não depende da natureza do soluto.
d) a presença de um gás em uma solução que depende do número de suas partículas agregadas presentes nessa solução, que não depende da natureza do soluto.
e) a presença de um líquido viscoso na forma de uma solução e a dependência do número de suas partículas agregadas nessa solução que não depende, no entanto, da natureza do soluto.
2) De acordo com o que aprendemos podemos afirmar que as principais propriedades coligativas são:
a) tonoscopia, que é a estabilização da pressão máxima de vapor, ebulioscopia, que é a diminuição da temperatura de ebulição, crioscopia, que é o abaixamento da temperatura de fusão, osmoscopia, que é a pressão osmótica.
b) tonoscopia, que é o aumento da pressão máxima de vapor, ebulioscopia, que é o aumento da temperatura de ebulição, crioscopia, que é o aumento da temperatura de fusão, osmoscopia, que é a pressão osmótica.
c) tonoscopia que é o aumento da pressão mínina de vapor, ebulioscopia que, é a elevação da temperatura de ebulição, crioscopia, que é o aumento da temperatura de fusão, osmoscopia que é a pressão osmótica ou o mesmo que difusão facilitada.
d) tonoscopia, que é a diminuição da pressão máxima de vapor, ebulioscopia, que é a elevação da temperatura de ebulição, crioscopia que é o abaixamento da temperatura de fusão, osmoscopia que é a pressão osmótica.
e) tonoscopia, que é o abaixamento da pressão mínima de vapor, ebulioscopia que é a elevação da temperatura de congelamento, crioscopia, que é o abaixamento da temperatura de ebulição, osmoscopia, que é a pressão osmótica.
3) Podemos definir tonoscopia como:
a) uma propriedade coligativa que constitui no aumento da pressão máxima de vapor (PMV) de um soluto quando se adiciona a ele um solvente não volátil.
b) uma propriedade coligativa que consiste na diminuição da pressão máxima de vapor (PMV) de um solvente quando se adiciona a ele um soluto não volátil.
c) uma propriedade coligativa que constitui na diminuição da pressão máxima de vapor (PMV) de um solvente quando se adiciona a ele um soluto bem volátil.
d) uma propriedade coligativa que constitui na neutralização da pressão de congelamento (PC) de um solvente quando se adiciona a ele um soluto não volátil.
e) a propriedade coligativa que corresponde ao aumento do ponto de ebulição de um líquido alcalino quando acrescenta-se a ele um soluto não-volátil.
4) Por definição podemos dizer que a ebulioscopia consiste na elevação da temperatura de ebulição.
Então é correto afirmar que:
a) ebulioscopia é a propriedade coligativa correspondente a diminuição do ponto de ebulição de um líquido quando acrescenta-se a ele um soluto não-volátil.
b) ebulioscopia é uma propriedade coligativa que constitui na diminuição da pressão máxima de vapor (PMV) de um solvente quando se adiciona a ele um soluto não volátil.
c) ebulioscopia é a propriedade coligativa correspondente ao aumento do ponto de congelamento de um gás quando acrescenta-se a ele um soluto não-volátil.
d) ebulioscopia é a propriedade coligativa correspondente ao abaixamento da temperatura de solidificação de um líquido quando acrescenta-se a ele um soluto não eletrolítico e não-volátil.
e) ebulioscopia é a propriedade coligativa correspondente ao aumento do ponto de ebulição de um líquido quando acrescenta-se a ele um soluto não-volátil.
5) Podemos dizer que a crioscopia significa; abaixamento da temperatura de fusão, com diminuição da pressão de vapor da solução, e por consequência da temperatura de ebulição.
É correta somente a alternativa.
a) crioscopia é a propriedade coligativa que correspondente a diminuição do ponto de ebulição de um líquido quando se acrescenta a ele um soluto não volátil.
b) crioscopia é uma propriedade coligativa que constitui na diminuição da pressão máxima de vapor (PMV) de um solvente quando se adiciona a ele um soluto não volátil.
c) crioscopia é a propriedade coligativa que correspondente ao aumento do ponto de congelamento de um gás quando se acrescenta a ele um soluto não volátil.
d) crioscopia é a propriedade coligativa que correspondente ao abaixamento da temperatura de solidificação de um líquido ou da fusão de um sólido quando se acrescenta a ele um soluto não eletrolítico e não volátil.
e) crioscopia é a propriedade coligativa que correspondente ao aumento do ponto de ebulição de um líquido quando se acrescenta a ele um soluto não volátil (que não evapora).
6) Nos países frios em dias de temperaturas baixíssimas, é adicionado nos veículos um anticongelante na água dos radiadores para não causar danos por meio desse equipamento de refrigeração.
Podemos afirmar que os anticongelantes e os combustíveis respectivamente, podem ser usados por possuir baixo ponto de congelamento e alto ponto de ebulição somente a alternativa:
a) o etilenoglicol (C2H6O2) P.F. -12,9ºC, P.E. -197ºC, propilenoglicol (CH3CHOHCH2OH) P.F. -59°C , P.E 188.2 °C , metanol (CH3OH) P.C. -98ºC, P.E. 65ºC, etanol (CH3CH2OH), P.C -115ºC e P.E. 78ºC.
b) o hexanol (C6H3OH) P.C. 12,9ºC, P.E. 197ºC, propilenoglicol CH3CHOHCH2OH, P.F. -59°C , P.E 188.2 °C , metanol (CH3OH) P.F -98ºC, P.E. 65ºC, etanol (CH3CH2OH) P.C. ? 115ºC P.E. 78ºC.
c) o acetileno (C2H2) P.F.- 83,8ºC, propilenoglicol (CH3CHOHCH2OH) P. F. -59°C , P.E. 188.2 °C , metanol (CH3OH) P.C. -98ºC, P.E. -65ºC.
d) o propano (C3H8) P.C. -187,68 oC , P.E. -197ºC, propilenoglicol (CH3CHOHCH2OH) P.E, metanol (CH3OH) p. C. -98ºC P.E. 65ºC, etanol (CH3CH2OH) P.C -115ºC P.E. 78ºC.
e) o benzeno (C6H6) P.E. -197ºC, propilenoglicol (CH3CHOHCH2OH) P.E.- 65ºC, metanol (CH3OH), etanol (CH3CH2OH) P.C. -115ºC, P.E. 78ºC.
7) (Ita-SP) Qual das opções abaixo contém a sequência correta de ordenação da pressão de vapor saturante das seguintes substâncias; CO2 (dióxido de carbono) cujo ponto de ebulição é 216 K, Br2 ( dibromo ou bromo molecular) o qual tem o ponto de ebulição 332 K, e Hg (mercúrio) de ponto de ebulição 629,88 K, na temperatura de 25ºC?
a) PBr2 > PCO2 > PHg.
b ) PHg > PBr2 > PCO2.
c) PCO2 > PBr2 > PHg.
d) PHg > PCO2 > PBr2.
e) PCO < PBr > PHg.
8) Nas conservas e compotas quando se coloca pêssegos, figos ou abacaxi, em solução concentrada de açúcar (calda grossa), a água e o açúcar flui para o interior do pêssego, do figo ou do abacaxi tornando-o doce. Que interpretação nós damos ao processo da passagem da água através de membrana semipermeável de um meio com soluto menos concentrado para um meio mais concentrado?
a) Nós podemos interpretar esse fenômeno como fusão de líquidos, que é o processo físico-químico de movimento da água entre meios com concentrações diferentes de solutos, separados por uma membrana semipermeável.
b) Nós podemos interpretar esse fenômeno como osmose, que é o processo físico-químico de movimento da água entre meios com concentrações diferentes; de soluções menos concentrada para a mais concentrada, separadas por uma membrana semipermeável.
c) Nós podemos interpretar esse fenômeno como difusão não espontânea de solutos, que é o processo físico-químico de movimento do soluto entre meios com concentrações diferentes de água, separados por uma membrana semipermeável.
d) Nós podemos interpretar esse fenômeno como osmose, que é o processo físico-químico de movimento do soluto entre meios com concentrações diferentes de água, separados por uma membrana semipermeável.
e) Nós podemos interpretar esse fenômeno como condensação, que é o processo físico-químico de movimento do soluto entre meios com concentrações diferentes de água, separados por uma membrana semipermeável.
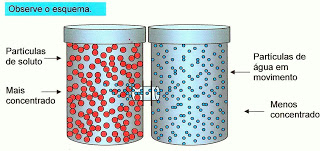
9) Observe o esquema abaixo.

Nós sabemos que a água quando separada por uma barreira semipermeável, sempre se desloca do meio hipotônico para o meio hipertônico até o equilíbrio. Então podemos afirmar que:
a) Um meio isotônico é aquele em que a água inicialmente flui de um meio hipertônico para o hipotônico, até a concentração se desequilibrar.
b) Um meio isotônico é aquele em que a água inicialmente flui de um meio hipotônico para o hipertônico, até a concentração se equilibrar.
c) Um meio isotônico é aquele em que o líquido inicialmente flui do meio hipotônico para o hipertônico, até a concentração do soluto se baixar.
d) Um meio isotônico é aquele em que o líquido está saturado de soluto que passou do meio hipertônico, até a concentração do solvente aumentar no lado hipotônico.
e) Um meio hipotônico é aquele em que o líquido inicialmente flui de um meio hipertônico para o isotônico, até a concentração do soluto se equilibrar.
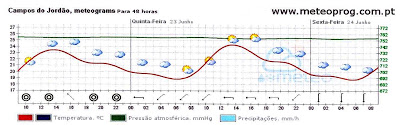
10) Observe o gráfico abaixo.

( FEI-SP) (adaptado) Aquecendo água destilada, numa panela aberta na cidade de Campos do Jordão de altitude de 1628 metros , onde foi registrado a pressão atmosférica ambiente (linha verde) marcada durante 48 horas nos dias 22, 23, 24 de Junho de 2011, dando uma média de aproximadamente 0,98 atm de pressão. Pergunta-se: a temperatura de ebulição da água:
a) será inferior a 100 ºC.
b) depende da rapidez do aquecimento.
c) será igual a 100ºC.
d) é alcançada quando a pressão máxima de vapor saturante ser 1 atm.
e) será superior a 100ºC.
Consultar.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto - Química na abordagem do cotidiano -volume 2, físico-química, terceira edição. São Paulo, 2003. Editora Moderna.Tonoscopia ? Wikipédia, a enciclopédia livre
WWW.meteoprog.com.pt
loading...
- Questões Sobre Transformações Químicas
Primeiro bimestre ? Avaliação 1ª Séries A; B; C; TA; TB. 1) O mineral com o qual se produz a cal virgem ou hidratada, que é empregado na construção civil é: a) NaCO3 - carbonato de sódio. b)...
- A QuÍmica Em Favor Do Tempo E Economia!
Bolsista: Gisléia Chaves Olá amigos do Quipibid! Hoje iremos destacar um instrumento usado pelas donas de casa em favor do tempo e economia na arte de cozinhar. Este instrumento irá...
- O Que A Química Tem Haver Com Cozinhar Alimentos???
Voluntária: Nara Alinne N. da Silva O que é o certo quando vamos cozinhar verduras, frutas ou legumes: Cozinhar com sal ou sem sal? O ideal é que cozinhemos...
- Concentração De Soluções
bolsista: Litton Jr. Olá amigos do QUIPIBID! A matéria dessa semana da nossa coluna dicas de vestibular, vamos falar sobre um assunto bem cobrado nas provas de vestibulares. Estamos falando de concentração de soluções, como...
- Atividade De Recuperação De Estudos - Soluções - Atividade N° 01
É hora de exercícios! Nesta atividade os alunos devem observar os conteúdos estudados em sala como: SolubilidadeA solubilidade varia com a temperatura.A solubilidade de alguns solutos aumenta com o aumento da temperatura.A temperatura é um fator...
