Química
Alcenos
Alcenos ou alquenos são hidrocarbonetos insaturados, cujas cadeias carbônicas principais geralmente são acíclicas e possuem uma única dupla ligação entre os seus carbonos da cadeia principal.
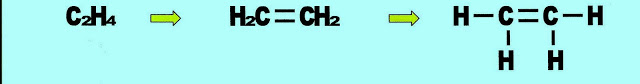
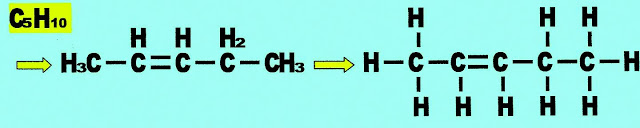
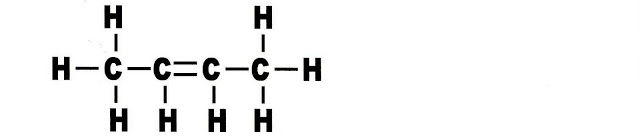
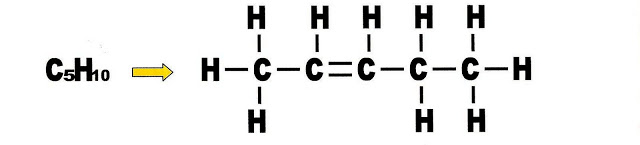
 Penteno
Penteno
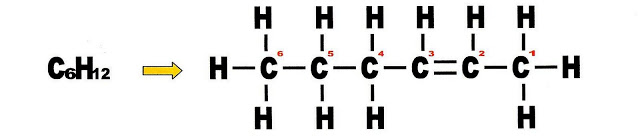
 Hexeno
Hexeno
 Cicloalquenos
Cicloalquenos
Ciclobuteno ciclopenteno

O Uso dos Alcenos ? Importância Industrial
2-metil-hex-3-eno, IUPAC.
O radical metil está no carbono 2 e a dupla ligação está no carbono 3. A molécula recebe o nome de 2-metil-3-hexeno.


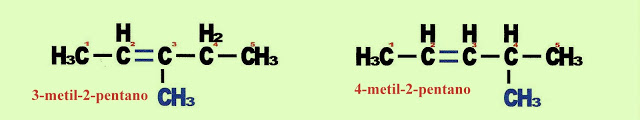
Na primeira figura a seguir é apresentada a forma Cis do feromônio.



Na formação do poliestireno primeiramente o estireno por meio de alta pressão atmosférica, com alta temperatura, juntamente com um catalisador, pela reação de adição, forma a unidade do monômero estireno.
 A polimerização de múltiplos polímeros do estireno formando o poliestireno pode ser representado da seguinte maneira.
A polimerização de múltiplos polímeros do estireno formando o poliestireno pode ser representado da seguinte maneira.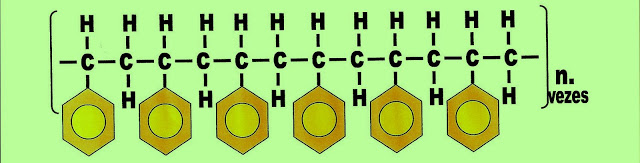 Tem o seu uso como isolante elétrico e térmico, na produção de boias em geral, isopor etc.
Tem o seu uso como isolante elétrico e térmico, na produção de boias em geral, isopor etc.

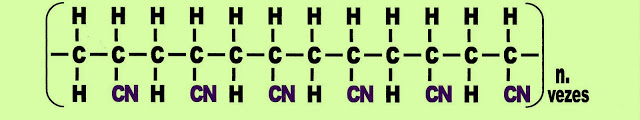 Polímero de acrilonitrila ou orlon
Polímero de acrilonitrila ou orlon
O Uso do Polímero

5) Das moléculas apresentadas abaixo é alceno somente a alternativa:
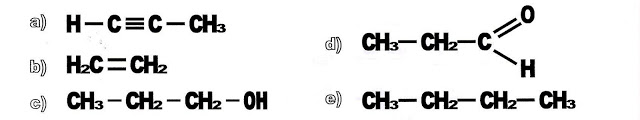
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )
o PVC (policloreto de vinila) - tecplastico
tecplastico.no.comunidades.net/index.php?pagina=1382744009
(pdf) Etileno - Fisiologia Vegetal - UFC
www.fisiologiavegetal.ufc.br/...Grad%20Unidade%20IX%20-...
Texto em construção.
- Funções Orgânicas E Nomeclatura
Dentro da química orgânica existem as funções orgânicas (compostos ôrganicos de características químicas e físicas semelhantes). Existem muitas funções, sendo as mais comuns:· Hidrocarbonetos (Alcanos, Alcenos, Alcinos, Alcadienos, Alcadiinos,...
- Química Orgânica - Alcadienos
Alcadienos - Dienos Alcadienos são hidrocarbonetos com a cadeia carbônica principal,...
- Polímeros Sintéticos Na Constituição De Matérias Do Cotidiano
Bolsista: Roniel Francisco dos Santos Olá pessoal do blog Quipibid, hoje vamos falar um pouco sobre um produto químico que invadiu o nosso dia a dia, os polímeros sintéticos. Os humanos já nascem com a presença...
- Nomenclatura De Alcenos - Exercícios Resolvidos
Alcenos são compostos orgânicos, hidrocarbonetos, de cadeia aberta que possuem uma única ligação dupla entre carbonos.Alcadienos são compostos de cadeia aberta que apresentam duas ligações duplas entre carbonos.Abaixo podemos observar alguns exemplos...
- Exercícios Resolvidos E Comentados - Avaliação De Química Orgânica - Função Hidrocarbonetos
Avaliação de Química Orgânica - 2011 - HIDROCARBONETOS 1) (UFSC) Um alcano encontrado nas folhas de repolho contém em sua fórmula 64 átomos de hidrogênio. Quantos átomos de carbono esse composto apresentam? 2) Em relação aos alcenos, indique:a)...
Química
Química Orgânica - Alcenos
Estados Físicos Dos Alcenos
Quanto aos estados físicos, os alcenos com o número de carbonos de 2 a 4 são gasosos. Os de cadeias com 5 a 15 carbonos são líquidos e os alcenos com cadeias carbônicas principais com 16 carbonos ou mais, se apresentam na forma sólida (lembrar que a dupla ligação indica insaturação).
A Solubilidade Dos Alcenos
São insolúveis em água, porém; são solúveis em solventes orgânicos e também no SO2, (gás sulfuroso líquido), acetona, ou ciclohexanona, os de cadeias com poucos carbonos apresentam menor densidade que a água.
Alguns Exemplos de Alcenos Mais Comuns
Eteno ou etileno
Eteno ou etileno
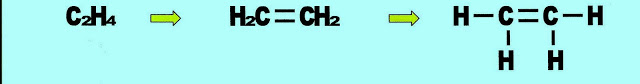
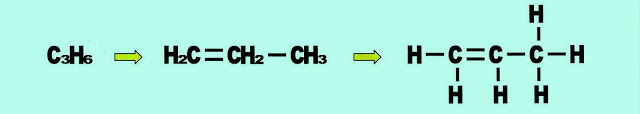
Propeno ou propileno

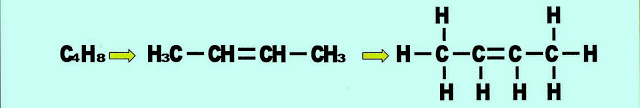
Buteno ou butileno



Ciclobuteno ciclopenteno

O Uso dos Alcenos ? Importância Industrial
Obtenção dos Alcenos
Obtenção do Gás Etileno
O eteno ou etileno é uma fração do petróleo, é obtido pelo seu craqueamento, a partir da nafta e destilação.
Pode ser obtido da cana de açúcar do álcool etílico anidro ou aquoso, desidratando-o com a ajuda de catalisador aluminossilicato cristalino.
Pode ser extraido pelo aquecimento e destilação do carvão hulha.
Pode ser obtido dos gases naturais ou simplesmente pela desidrogenação do etano com auxílio de catalisador.
Frutas como o tomate o caqui, nectarina, maçã, banana, manga e verduras, o espinafre, brócolis, alface, além dessas, outras frutas e verduras também produzem o gás etileno.

Foi comprovado desde 1934, quando Gane demonstrou que as plantas também produzem o gás etileno, sendo que este mesmo gás era o responsável pelo amadurecimento dos frutos. Segundo alguns pesquisadores, há uma variedade de espécies e classes de plantas, tais como as angiospermas, gimnospermas, fungos, cianofícieas e até bactérias podem produzir a substância que interage também no florescimento das plantas produtoras.
O Uso do Eteno
Do eteno pode-se obter álcool, especialmente nos países onde não é cultivada a cana-de-açúcar.
Polietileno - HDPE
Identificação 2 para reciclagem.
Polietileno - HDPE
Identificação 2 para reciclagem.
Do eteno ou etileno pode-se obter plásticos o polietileno de alta densidade (PEAD) ou (HDPE) plástico do tipo 2 para reciclagem. Com o etileno são fabricados sacolas de supermercado, sacos de lixo, isolantes de cabos ou fios elétricos.

Os frascos ao lado são recipientes de óleo de motor de veículos automotores. São produzidos a partir do polietileno de alta densidade. (PEAD) ou (HDPE). Observa-se
a marca do tipo de plástico no fundo, do lado externo da embalagem.
Polietileno - LDPE
Identificação 4 para reciclagem.
Os frascos ao lado são recipientes de óleo de motor de veículos automotores. São produzidos a partir do polietileno de alta densidade. (PEAD) ou (HDPE). Observa-se
a marca do tipo de plástico no fundo, do lado externo da embalagem.
Polietileno - LDPE
Identificação 4 para reciclagem.
Com o eteno obtém-se também o plástico (PEDB) ou (LDPE) de baixa densidade do tipo 4 para reciclagem. São produzidos com esse plástico, sacolas de supermercado, embalagens para detergentes, engradados de bebidas.
Policloreto de Vinila - PVC
Identificação 3 para reciclagem.
Policloreto de Vinila - PVC
Identificação 3 para reciclagem.
Dos polímeros do etileno é obtido por transformações, o P.V.C., cloreto de polivinila ou poli cloreto de vinila,plástico do tipo 3 para reciclagem. São produzidos a partir desse plástico, tubos de PVC de encanamento de água e esgoto residenciais e industriais, couro artificial, tubos ou mangueiras, fabricação de sapatos e calças plásticas para bebês, cestos para papéis e materiais hospitalares.
Poliestireno (PS) - Isopor -
Identificação 6 para reciclagem.
Poliestireno (PS) - Isopor -
Identificação 6 para reciclagem.
O etileno ligado a um anel benzênico origina outro plástico muito importante na produção industrial, o vinil benzeno ou estireno, que ligado n-vezes, produz o poliestireno (PS). Desse material, através de injeção de ar, promotor de sua expansão, obtém-se o isopor que é o plástico expandido. Há uma quantidade muito grande de outros produtos e objetos obtidos a partir do poliestireno expandido que trataremos mais adiante.

O isopor (EPS) é usado como embalagem protetora no transporte de eletrodomésticos e eletrônicos. Ver foto ao lado.
Tem aplicação também na construção civil, em lages treliçadas termotécnica, é também usado no suporte do revestimento na fase de concretagem, possui boa aderência ao revestimento à base de cimento, é um excelente isolante térmico.
Etileno e Óxido de Etileno
Com o etileno pode-se obter o óxido de etileno que é usado na fabricação de explosivos, solventes e outro tipo de plástico muito conhecido por nós no cotidiano, o acrílico.
Politretrafluor de etileno (Politetrafluoroetileno) - Teflon

 O eteno associado ao flúor, forma o monômero tetrafluoroetileno que polimerizado, forma o politetrafluoroetileno (PTFE) que é o teflon, usado por exemplo; no revestimento de panelas e frigideiras anti-aderentes.
O eteno associado ao flúor, forma o monômero tetrafluoroetileno que polimerizado, forma o politetrafluoroetileno (PTFE) que é o teflon, usado por exemplo; no revestimento de panelas e frigideiras anti-aderentes.
O isopor (EPS) é usado como embalagem protetora no transporte de eletrodomésticos e eletrônicos. Ver foto ao lado.
Tem aplicação também na construção civil, em lages treliçadas termotécnica, é também usado no suporte do revestimento na fase de concretagem, possui boa aderência ao revestimento à base de cimento, é um excelente isolante térmico.
Etileno e Óxido de Etileno
Com o etileno pode-se obter o óxido de etileno que é usado na fabricação de explosivos, solventes e outro tipo de plástico muito conhecido por nós no cotidiano, o acrílico.
Politretrafluor de etileno (Politetrafluoroetileno) - Teflon
O rolinho de fita plástica acima é de PTFE
Propeno e Polipropileno
O propeno polimerizado também origina o polipropileno que é usado na fabricação de vários produtos, assim como fitas resistentes á tração, destinadas a amarrar embalagens.
Fibras de Polipropileno e Concreto Armado
Propeno Combustível
O propeno está misturado ao gás natural e é usado como combustível.
Buteno ou Butileno
Obtenção do buteno
O buteno pode ser obtido do petróleo por decomposição térmica e destilação.
O buteno na forma do isobutileno é usado na sintetização de plásticos e elásticos. Os elásticos são polímeros de isobutileno, é o mesmo que poli-iso-butileno formador de elásticos, Com o butileno se fabrica borrachas sintéticas ou borracha butílica. Trataremos do assunto borrachas em alcadienos.
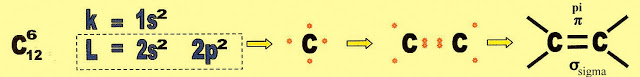
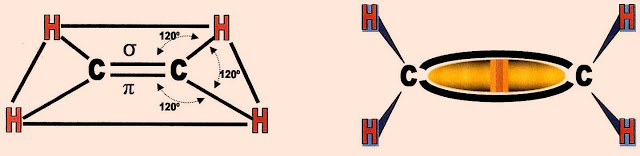
A ligação dupla que acontece entre os dois carbonos, a primeira é a pi, que é fraca e a ligação sigma é forte.
A Hibridação sp2 do carbono




O propeno polimerizado também origina o polipropileno que é usado na fabricação de vários produtos, assim como fitas resistentes á tração, destinadas a amarrar embalagens.
Fibras de Polipropileno e Concreto Armado
Do polipropileno são obtidas por extrusão, multifilamentos finos, ou seja; uma espécie de lã de fibras, de estrutura finíssima que, quando misturadas na preparação do concreto e também de argamassas que são usadas em pisos e pavimentos de construção civil, formam um composto homogêneo que impede a abertura de fissuras ou rachaduras, durante a secagem dos mesmos, ou pós o amadurecimento, ou na expansão e contração físicas comum, que acontece durante todo o tempo de vida da estrutura do concreto armado. Propicia ainda uma melhora no desempenho do endurecimento do preparado, resistência ao fogo, a impactos, e uma melhor dureza ao desgaste de um modo geral.
Propeno Combustível
O propeno está misturado ao gás natural e é usado como combustível.
Buteno ou Butileno
Obtenção do buteno
O buteno pode ser obtido do petróleo por decomposição térmica e destilação.
O buteno na forma do isobutileno é usado na sintetização de plásticos e elásticos. Os elásticos são polímeros de isobutileno, é o mesmo que poli-iso-butileno formador de elásticos, Com o butileno se fabrica borrachas sintéticas ou borracha butílica. Trataremos do assunto borrachas em alcadienos.
As Ligações que Formam os Alcenos - A Formação da Dupla Ligação
Começamos pela valência do carbono e o arranjo dos seus elétrons na formação da dupla ligação.

A Hibridação sp2 do carbono
O átomo de carbono, no estado normal não se liga a outro carbono e portanto não pode formar as moléculas e por consequência as substâncias. Para se ligar a outro átomo, o carbono deve sofrer transformações na sua estrutura atômica e passar por fases de ativação e hibridação. Vamos observar a sequência dessas transformações a partir do átomo no seu estado fundamental.
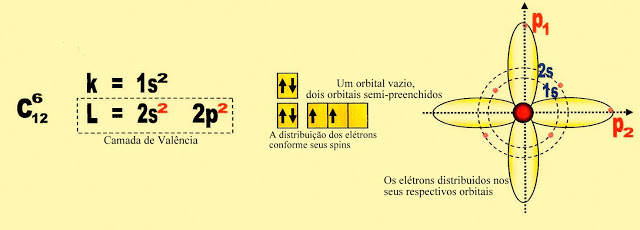
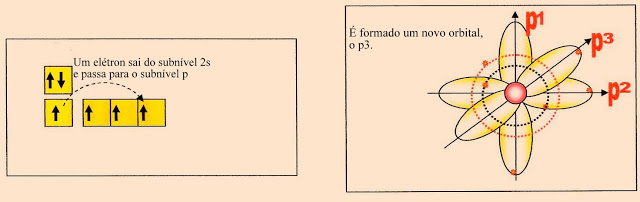
O Carbono no Estado FundamentalNo estado fundamental o carbono apresenta na sua camada de valência dois elétrons no orbital ?2s? e dois elétrons no orbital ?p? puro. Observe o esquema abaixo.

O Carbono Ativado
Ao ser ativado, um elétron do subnível ?2s? da camada de valência passa para o subnível ?p3? formando mais um orbital ?p? puro semi preenchido.

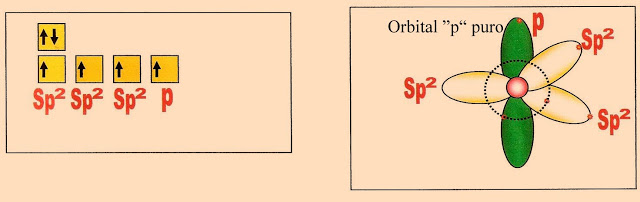
O Carbono Hibridizado
No carbono, ao hibridizar, ocorre nova mudança nos orbitais do átomo, o orbital ?2s? circular se alonga formando um orbital ?sp? híbrido, concomitantemente dois dos orbitais ?p? puros encolhem tomando a configuração na forma de orbital ?sp? também híbridos, restando apenas um orbital ?p? puro que permanece estável. Observe o que acontece no esquema abaixo.

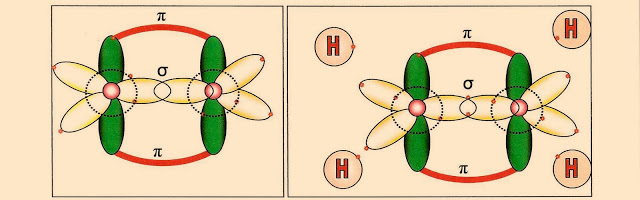
Dois átomos de carbono hibridizados aproximam seus orbitais sp2 semi preenchidos.

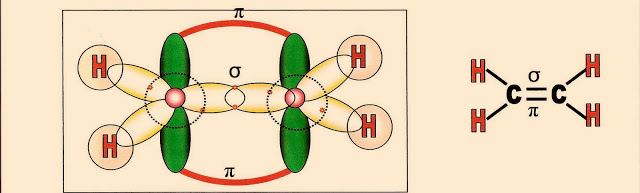
Abaixo é representado esquematicamente as ligações entre os dois átomos de carbono que se completam, quando são formadas duas ligações, uma pi (?) entre orbitais ?sp2? e outra sigma (?) pelos orbitais ?p? puro. Em seguida os átomos de hidrogênio se aproximam dos orbitais sp2 semi preenchidos.

E finalmente a molécula do alceno está formada e é representada:

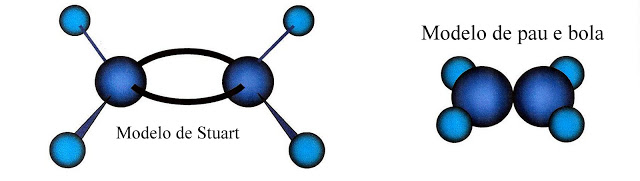
Outros Modelos Para a Representação do Eteno
Observe que os ângulos das ligações sigma-sigma, ou sigma-pi, entre carbono e hidrogênio possuem abertura de 120º.
Observe que os ângulos das ligações sigma-sigma, ou sigma-pi, entre carbono e hidrogênio possuem abertura de 120º.


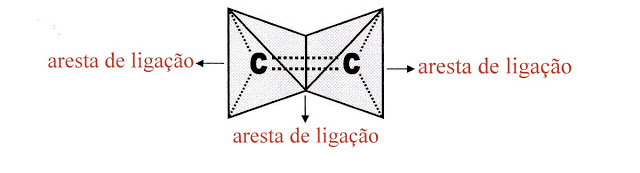
O eteno também pode ser representado sob a forma de dois tetraedros ligados pela aresta central.

A Nomenclatura Dos Alcenos
A sigla IUPAC significa :International Union of Pure and Applied Chemistry é o órgão que regulamenta, padronizando a nomenclatura da química a nível internacional.
Os alcenos podem ser nomeados similarmente aos alcanos com a diferença de que substitui-se a terminação "ano" por "eno".
Eteno
Primeiro passo: numera-se a cadeia principal. Cadeia com dois carbonos - recebe o prefixo "et" + terminação "eno" - eteno.

Propeno ou propileno
Três carbonos - recebe o prefixo "prop" + numeração + terminação "eno" - prop-1-eno, IUPAC. propileno é nomenclatura genérica.

A mesma molécula do propeno pode ser representada pelas estruturas:

Buteno
Quatro carbonos - recebe o prefixo "but" + numero do carbono onde está a dupla ligação terminação "eno", but-2-eno, IUPAC, a dupla ligação está no carbono 2.

A mesma molécula do buteno pode ser representada pelas estruturas:

Penteno
Cadeia com cinco carbonos recebe o prefixo ?pent? + número do carbono onde está a dupla ligação + terminação ?eno? ? como a dupla ligação está no carbono dois, recebe a nomenclatura de pent-2-eno, IUPAC.

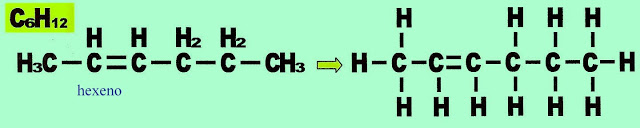
Hexeno
Observe que ao mudar a dupla ligação na cadeia carbônica principal, muda também o lado de numeração da própria cadeia. Cadeia com seis carbonos recebe o prefixo de ?hex? + número do carbono onde está a dupla ligação + terminação ?eno?. Como a dupla ligação está no carbono 2, a nomenclatura dada é hex-2-eno, IUPAC.

A Nomenclatura dos Alcenos Ramificados
Para entendermos a nomenclatura dos alcenos ramificados é necessário conhecermos os seus radicais. Os radicais possuem valência livre o que significa a existência de um elétron livre na sua extremidade, esse elétron é o responsável pela ligação à outra valência livre da molécula receptora desse radical.




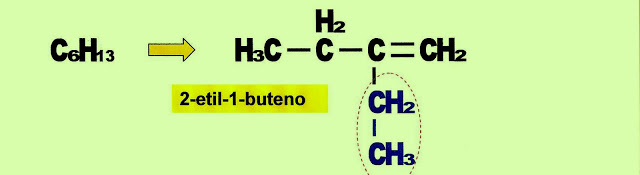
2-etil-but-1-eno, IUPAC
Primeiramente colocamos o número do carbono em que o radical está ligado, em seguida o seu nome e o nome provindo do número de carbonos da cadeia principal, acrescido da terminação "eno".
Os Radicais Dos Alcenos
O Radical Vinil ou Etenil.
O radical vinil ou etenil (nome genérico) é formado pela saída de um hidrogênio de uma das extremidades da molécula do eteno.

O Radical Alil
O radical alil é formado pela saída de um hidrogênio de uma das extremidades da molécula do propeno deixando um elétron livre no local.

Radical Propenil

Radical Isoprenil
O radical isoprenil é formado pela saída de um hidrogênio do carbono do propeno deixando uma valência livre.
O radical isoprenil é formado pela saída de um hidrogênio do carbono do propeno deixando uma valência livre.

Nomenclatura dos Alcenos Ramificados
2-etil-but-1-eno, IUPAC
Primeiramente colocamos o número do carbono em que o radical está ligado, em seguida o seu nome e o nome provindo do número de carbonos da cadeia principal, acrescido da terminação "eno".


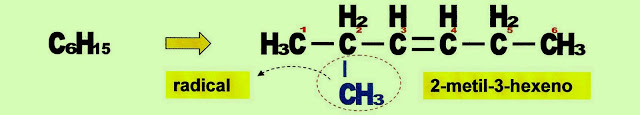
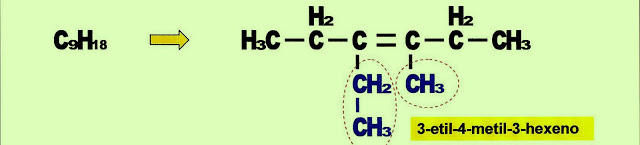
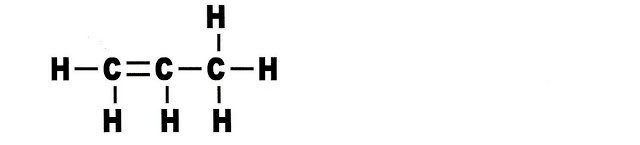
3-etil-4-metil-hex-3-eno, IUPAC.
Na formação do 3-etil-4-metil-3-hexeno, o radical etil está no carbono 3 e o radical metil está no carbono 4, enquanto que a dupla ligação está no carbono 3.

A Isomeria Dos Alcenos
Isômeros nessa palavra ? iso, significa igual e meros, significa partes. Podemos dizer que os isômeros possuem os mesmos elementos químicos e a mesma proporção desses elemento em uma molécula. No entanto as substâncias que esses elementos químicos formam, na mesma proporção, são diferentes.
Isomeria de Cadeia
Os isômeros de cadeia podem aparecer entre as moléculas como o ciclobutano e o 2-buteno, ambos de cadeias carbônicas diferentes, uma cíclica e outra linear.

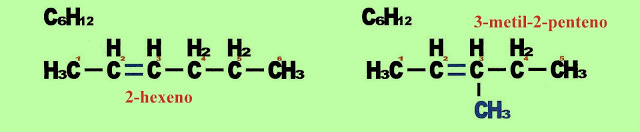
Pode acontecer a isomeria de alceno de cadeia aberta sem radical, por exemplo o 2-hexeno, com outro alceno de cadeia aberta com radical metil, o 3-metil-pent-2-eno, IUPAC.

Isomeria de Posição
Isomeria de Posição da Dupla Ligação
Na primeira molécula (1-buteno), a dupla ligação está no carbono 1 e na segunda molécula (2-buteno), a dupla ligação está no carbono 2.

Isomeria de Posição do radical
Na primeira molécula, o radical metil está no carbono 3 e na segunda molécula o radical metil está no carbono 4. Veja, que é a posição da dupla ligação que comanda a numeração dos carbonos na cadeia principal.
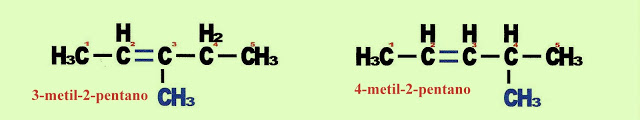
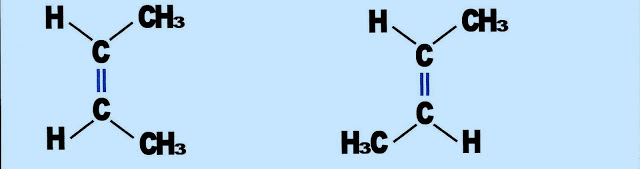
Isomeria Espacial, Cis?Trans ou Geométrica
A expressão Cis significa do mesmo lado, enquanto que Trans o lado oposto, ou transversal. Esse tipo de isômero qualifica-se como geométrico devido a sua forma apresentada, de dois tetraedros interligados.
A Isomeria e a Forma de Projeção
A Representação do Buteno Pela Fórmula de Projeção
Cis-2-buteno Trans-2-buteno

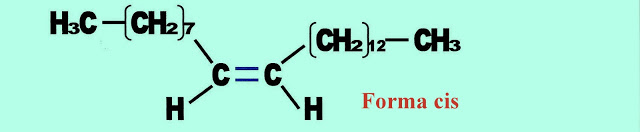
Isomeria Geométrica - Cis ? Trans ? Na Natureza e Aplicações de Controle
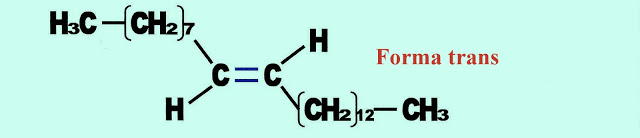
Como as outras, na natureza a isomeria geométrica - Cis ? Trans - pode aparecer aplicada. Podemos observar isso, com o feromônio Cis-9-tricoseno (C23H46), produzido pela mosca doméstica como atraente sexual. Somente um dos isômeros deles pode ser o motivo atrativo para o acasalamento da mosca doméstica. Entretanto ocorre existência dos dois tipos que podem ser; a forma Cis ou Trans. Enquanto uma age ativamente, a outra forma é inerte. As pesquisas laboratoriais revelaram que o feromônio sexual na forma Cis era o atuante como isca, quando fora aplicado em armadilhas para insetos, enquanto que o na forma trans era inerte, não atraia os insetos para as armadilhas. Atualmente a forma Cis é produzido industrialmente, sendo um produto comercial vendido como inseticida para aplicação na agricultura.

Na figura logo a seguir é apresentada a forma Trans do feromônio.

Podemos ainda ver outros exemplos de isomeria Cis-Trans.
Cis-1.2-dicloro-eteno Trans-1,2-dicloro-eteno

Reações Dos Alcenos
Polimerização
A polimerização consiste em juntar por reações químicas, duas ou mais moléculas ou monômeros e chegar a centenas de milhares, para formar uma estrutura com as múltiplas unidades iniciais denominada de polímero.
A Polimerização do Polietileno
Polimerização Linear
A polimerização para a formação do plástico polietileno comum, é um tipo de polimerização linear.
Na polimerização, os monômeros do eteno ou etileno por transformação química, com o uso de catalisador, temperatura de 300ºC e 200 atmosferas de pressão, que rompe a dupla ligação do etileno, formando a seguinte estrutura:
Na formação do monômero do polietileno utiliza-se o etileno em alta pressão atmosférica 200 atms, temperatura de 300 graus Celsius de temperatura e um catalisador que pode ser o dicloreto de diciclopentadienil-zircônio ou do tipo peróxidos.

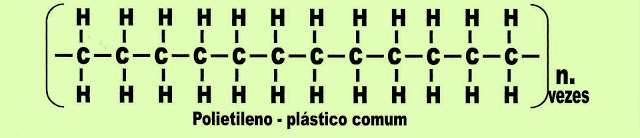
Polietileno plástico comum

Moléculas longas com até 100.000 monômeros forma um material sólido e bem compacto, com pouca ramificações na cadeia, forma o polietileno de alta densidade, PEAD ou em Inglês HDPE ou PE-HD, de peso aproximadamente 0,93 a 1,0 g/cm³ de alta resistência à tensão, compressão e tração, com o qual se produz por exemplo, peças de dominó, embalagens para detergentes, shampoos, caixas plásticas para peixes, refrigerantes, cervejas, tubos para condução de gás, tubos plásticos para telefonia. Já o PEBD ou em Inglês LDPE o mesmo que PE-LD, polietileno de baixa densidade, possui cadeias de polímeros menores com o qual são feitos os sacos de lixo, as sacolas plásticas , tubo de canetas esferográficas.
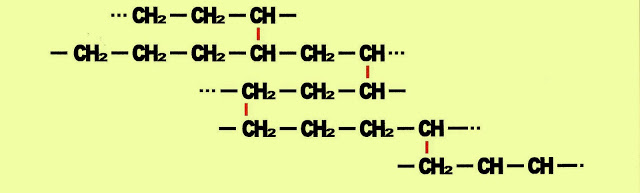
 Plástico PEBD
Plástico PEBD
O polímero de baixa densidade, (PEBD) com característica mais flexível, pode ser representado com suas ligações entre as cadeias carbônicas desse modo:

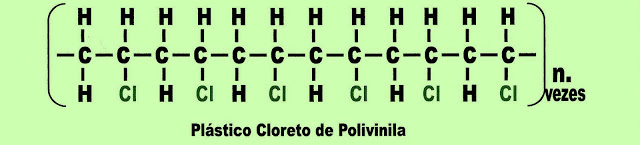
A Polimerização do Plástico P.V.C. - Cloreto de Polivinila
O plástico cloreto de polivinila é produzido a partir da associação do cloro à estrutura molecular do seu monômero.


O cloreto de polivinila pode ser utilizado para a produção de tubos plásticos de encanamento de água, de galões plásticos, frascos plásticos para shampoos, loções, luvas, sapatos, revestimento de estofados etc.
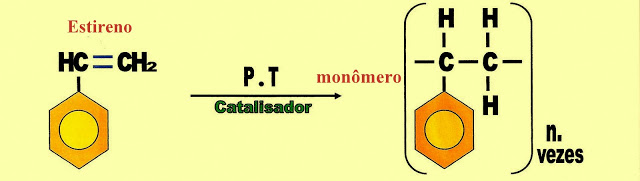
A Polimerização do Plástico Polivinilbenzeno - Estireno ou Isopor
Na formação do poliestireno primeiramente o estireno por meio de alta pressão atmosférica, com alta temperatura, juntamente com um catalisador, pela reação de adição, forma a unidade do monômero estireno.


Plástico Poliacrilonitrila ou Orlon
Existem mais de um processo de obtenção da poliacrilonitrila. No processo abaixo, o etileno sofre adição do grupo funcional nitrila (CN), e se transforma em acrilonitrila.

Convém salientar que nos múltiplos processos de obtenção do plástico poliacrilonitrila são usados, para cada um tipo ou método, um catalisador específico. Porém como há técnicas de obtenção diferentes, os que foram colocados acima o persulfato de ferro II, Clorato de ferro II, e o bissulfito, representam demonstrativamente a necessidade de seu uso.

O Uso do Polímero
O plástico poliacrilonitrila pode ser utilizado na produção de fibras têxteis sintéticas para cobertores, mantas, tapetes, carpetes, bichos de pelúcia, aviação militar, fibras para veículos automotores, roupas de uso por atletas. No Brasil a Radicifibras é a mais importante produtora de fibras a base de poliacrilonitrila.
Polímero do teflon
O tetrafluoretileno se transforma no tetrafluoretano

O monômero do tetrafluoretileno se transforma no polímero do tetrafluoretileno ou teflon
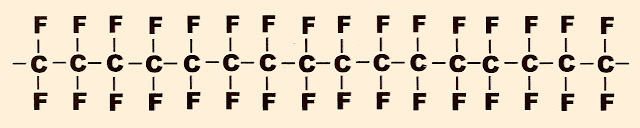



Polímero do teflon
O tetrafluoretileno se transforma no tetrafluoretano

O monômero do tetrafluoretileno se transforma no polímero do tetrafluoretileno ou teflon

Outros Tipos de Reações Dos Alcenos
Além da produção de polímeros, os alcenos também podem reagir e produzir outras substâncias que se prestam à determinados fins.
Reação de Adição Dos Alcenos
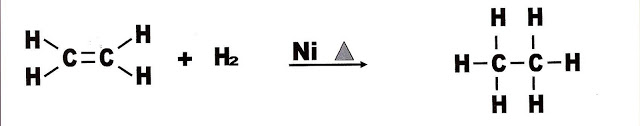
Reação de Adição de Hidrogênio
Nesse tipo de reação podemos transformar com a ajuda do catalisador níquel e temperatura ajustada, o eteno em etano pela adição de dois átomos de hidrogênio em sua estrutura molecular.

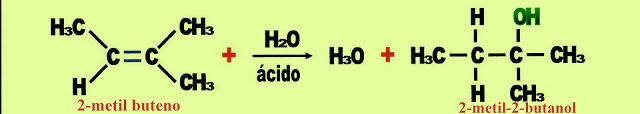
Reação de Adição de Água ? Hidratação Do Alceno
O 2-metil-buteno pela adição de água juntamente com um ácido sofre hidratação produzindo o álcool o 2-metil-2-butanol, álcool amílico de densidade igual a 0.8247 g/cm³. Esse álcool que anteriormente era usado em medicina pelos seus efeitos hipnóticos e sedativos quando ingeridos ou inalado, produzia efeitos similares ao do álcool etílico. É produzido industrialmente e usado para extração de enzimas de ligação das membranas da célula e citoplasmática, além de síntese do éster ginsenoside Rb1 (C54H92O23) do ginseng, que no organismo atua sobre a histamina e sobre as funções reguladoras cardíacas, combatendo a fadiga e o stress físico.

A Produção de Álcool Na Presença de Ácido
O etileno sofre hidratação em presença de água e ácido sulfúrico produzindo álcool etanol (C2H5OH).

Adição de Halogênio
O Eteno pode ser transformado em halogênio pela adição de flúor (F2), iodo (I2), cloro (Cl2) e bromo (Br2), por ação da luz na faixa lambda do espectro eletromagnético. Na reação a seguir, o cloro é adicionado ao eteno, sob a ação da luz e se transforma em 1,2-dicloro-propano.

Combustão Dos Alcenos
Os alcenos são muito reativos à chama e entram em combustão facilmente. Especialmente o gás etileno que ao reagir produz gás carbônico e água.

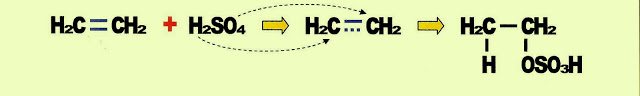
Adição de Ácido Sulfúrico
A adição de ácido sulfúrico ao etileno, provoca a saída de um átomo de hidrogênio do ácido, que passa para o etileno, ocorrendo a ?desintegração? da ligação ? do alceno, também sai um átomo de oxigênio do mesmo ácido que passa para o etileno formando o sulfato-ácido-de-etila, ou ácido-etil-sulfúrico.

Oxidação Dos Alcenos
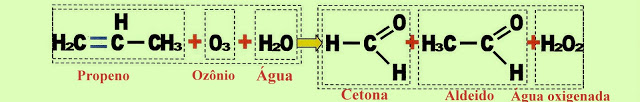
Formação de Aldeídos e Cetonas
O propeno reage com ozônio e água formando cetona, aldeído e água oxigenada.

Exercícios Simplificados
1) A característica principal dos alcenos ou alquenos ou olefinas é:
a) possuir duas duplas ligações entre os carbonos da cadeia principal.
b) possuir uma tripla ligação entre os carbonos da cadeia principal.
c) possuir ligações simples entre os carbonos da cadeia principal.
d) possuir uma única dupla ligação entre os carbonos da cadeia principal.
e) possuir várias duplas ligações entre os carbonos da cadeia principal.
2) São alcenos gasosos apenas:
a) os que possuem cadeias carbônicas com cinco ou mais carbonos.
b) os que possuem cadeias carbônicas acima de 15 carbonos.
c) os que possuem cadeias carbônicas com até 4 carbonos.
d) os que possuem cadeias carbônicas cíclicas apenas.
e) os que possuem cadeias carbônicas ramificadas apenas.
3) Quanto a solubilidade podemos dizer que os alcenos:
a) são muito solúveis em água, independente da quantidade de solvente que se utiliza.
b) geralmente são solúveis em água quente, e também são solúveis em gás sulfuroso líquido.
c) não são solúveis em água, são solúveis em gás sulfuroso líquido, acetona, ou ciclohexanona.
d) são pouco solúveis em água porém não necessitando de nenhum outro tipo de solvente.
e) possuem pouca solubilidade na água em temperaturas baixas.
4) O gás que participa do amadurecimento de frutas como o tomate o caqui, nectarina, maçã, banana, manga e verduras o espinafre, brócolis, alface e outros é o:
a) acetileno.
b) etileno.
c) propadieno.
d) propileno.
e) polietileno.
4) O gás que participa do amadurecimento de frutas como o tomate o caqui, nectarina, maçã, banana, manga e verduras o espinafre, brócolis, alface e outros é o:
a) acetileno.
b) etileno.
c) propadieno.
d) propileno.
e) polietileno.
5) Das moléculas apresentadas abaixo é alceno somente a alternativa:

6) Um tipo de plástico rígido com grande resistência à tração, com a sigla PEAD, com o qual se fabrica brinquedos, utensílios hospitalares, tubos para água e gás, tanques combustíveis para veículos automotores, frascos de óleos para motores de veículos, é o:
a) polietileno de Baixa Densidade ou código de identificação 4, para reciclagem.
b) polietileno de Ultra Alto Peso Molecular.
c) e o policloreto de vinila ou código de identificação 3.
d) politretrafluor de etileno ou código de identificação 7.
e) polietileno de alta densidade ou código de identificação, 2 para reciclagem.
7) O teflon é o plástico:
a) polipropileno.
b) poliestireno.
c) policloreto de Vinila.
d) politetrafluoroetileno.
e) polietileno.

8) Os isômeros possuem a mesma massa, os mesmos elementos químicos nas suas estruturas moleculares, mas suas funções são diferentes. O tipo de isomeria do ciclobutano com o but-2-eno apresentada abaixo é:

a) de posição.
b) de cadeia.
c) geométrica cis-trans.
d) isomeria óptica.
e) isomeria plana.
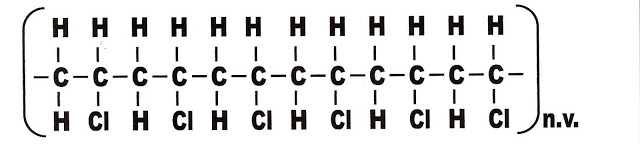
9) O cloro adicionado à cadeia carbônica principal, proporciona a característica específica do plástico cuja estrutura é apresentada a seguir. O segmento do polímero representado logo abaixo é do plástico:

a) P.V.C. - policloreto de vinila.
b) P.E. - polietileno.
c) P.S. - poliestireno.
d) P.T.F.E. - Politetrafluoroetileno.
e) P.P. - Polipropileno.
10) Observe a reação a seguir, que transforma o eteno em etano. Esse tipo de reação é:

a) reação de hidratação do alceno.
b) reação de subtração de hidrogênios.
c) reação de adição de halogênios.
d) reação de adição de hidrogênios.
e) reação de oxidação do alceno.
Bibliografia
o PVC (policloreto de vinila) - tecplastico
tecplastico.no.comunidades.net/index.php?pagina=1382744009
(pdf) Etileno - Fisiologia Vegetal - UFC
www.fisiologiavegetal.ufc.br/...Grad%20Unidade%20IX%20-...
loading...
- Funções Orgânicas E Nomeclatura
Dentro da química orgânica existem as funções orgânicas (compostos ôrganicos de características químicas e físicas semelhantes). Existem muitas funções, sendo as mais comuns:· Hidrocarbonetos (Alcanos, Alcenos, Alcinos, Alcadienos, Alcadiinos,...
- Química Orgânica - Alcadienos
Alcadienos - Dienos Alcadienos são hidrocarbonetos com a cadeia carbônica principal,...
- Polímeros Sintéticos Na Constituição De Matérias Do Cotidiano
Bolsista: Roniel Francisco dos Santos Olá pessoal do blog Quipibid, hoje vamos falar um pouco sobre um produto químico que invadiu o nosso dia a dia, os polímeros sintéticos. Os humanos já nascem com a presença...
- Nomenclatura De Alcenos - Exercícios Resolvidos
Alcenos são compostos orgânicos, hidrocarbonetos, de cadeia aberta que possuem uma única ligação dupla entre carbonos.Alcadienos são compostos de cadeia aberta que apresentam duas ligações duplas entre carbonos.Abaixo podemos observar alguns exemplos...
- Exercícios Resolvidos E Comentados - Avaliação De Química Orgânica - Função Hidrocarbonetos
Avaliação de Química Orgânica - 2011 - HIDROCARBONETOS 1) (UFSC) Um alcano encontrado nas folhas de repolho contém em sua fórmula 64 átomos de hidrogênio. Quantos átomos de carbono esse composto apresentam? 2) Em relação aos alcenos, indique:a)...
