Química
Recordando a Química Básica, sabemos que todo o átomo é formado basicamente de três partículas: prótons, nêutrons e elétrons. Através de uma representação do átomo podemos visualizar melhor essa teoria.

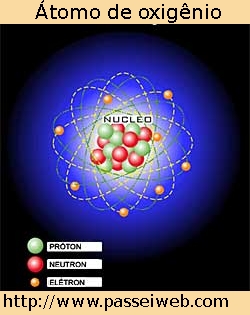
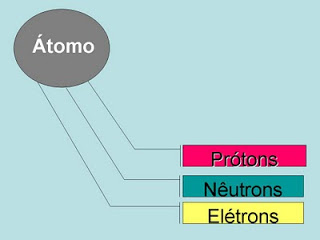
A tabela periódica fornece variadas informações a respeito dos elementos químicos, outros dados podemos obter utilizando cálculos simples, como exemplo:

Para a determinação da quantidade de nêutrons de um átomo podemos fazer o seguinte cálculo:
Carlos Alberto dos Santos - Instituto de Física ? UFRGS - Disponível em: http://www.sbpcnet.org.br/livro/60ra/textos/CO-CarlosAlbertoSantos.pdf Acesso em: 23/12/2010.

http://pt.wikipedia.org/wiki/Ernest_Rutherford
- Radioatividade
Radioatividade A foto foi retirada do arquivo de figuras da web. É um magnetar ou estrela de nêutrons que possui um poderoso campo magnético que emite para o espaço...
- História Da Radioatividade
Bolsista: Leidiane Rodrigues Rosa A radioatividade é definida como a capacidade que alguns elementos fisicamente instáveis possuem de emitir energia sob forma de partículas ou radiação eletromagnética.Após a descoberta da radioatividade...
- Modelo PlanetÁrio Do Átomo
Bolsista: Leidiane Rodrigues Rosa Falamos sobre um modelo atômico no post anterior: o da ?bola de bilhar?. Hoje vamos conhecer outro modelo: o modelo atômico de Rutherford, alguém conhece?Honrado como o pai da física nuclear, Ernest Rutherford foi...
- Leis Da Radioatividade - Exercícios Resolvidos
Exercícios de Fixação da Aprendizagem - Exercícios ResolvidosLeis da Radioatividade 1) Quando um dos isótopos do bismuto emite uma partícula alfa, há formação do Ti(A=210 e Z=81). Neste átomo pai, o número de prótons e o número...
- Atividade De QuÍmica N° 02 (tabela Z, A, P, N)
OLÁ ALUNOS! AS ATIVIDADES ABAIXO, DEVEM SER REALIZADAS EM FOLHA SEPARADA, NÃO ESQUECENDO DO CABEÇALHO COMPLETO DA INSTITUIÇÃO ESCOLAR QUE ESTÁ VÍNCULADO. BONS ESTUDOS.UM ABRAÇO DO PROF° RONALDO 1) Complete o quadro: ElementoZAPenCloro1735 ...
Química
Radioatividade.
Caso encontre locais com esta placa, CUIDADO!
RADIAÇÃO
 |
| imagem química ensinada |


A tabela periódica fornece variadas informações a respeito dos elementos químicos, outros dados podemos obter utilizando cálculos simples, como exemplo:
Para a determinação da quantidade de nêutrons de um átomo podemos fazer o seguinte cálculo:
O símbolo A significa Número de Massa.
O síímbolo p número de prótons e n número de nêutrons.
Exemplo:
1) O número de massa do elemento magnésio é 24 e sabendo que seu número atômico é 12. Calcule o seu número de nêutrons.
A = p + n
24 = 12 + n
n = 24 - 12
n = 12
2) Descubra o número de atômico e o número de massa do átomo de cloro, sabendo que ele tem dezessete prótons e dezoito nêutrons.
?
A = p + n
A = 17 + 18
A = 35
Sabendo que, Z = p = e, podemos concluir que o número atômico do átomo de cloro é 17.
Estes cálculos são úteis para a memorização de algumas características atômicas.
As Radiações são classificadas em:
Radiações Ionizantes
Radiações Não-Ionizantes
HISTÓRICO DA RADIOATIVIDADE




Trabalhando o texto:
RADIAÇÃO E VIDA!

Disponível em: ?http://www.quimica.seed.pr.gov.br/arquivos/File/seed_quim_e_book.pdf
Acesso em: 20/12/2010.
O texto acima é uma publicação oficial do livro Didático Público do Paraná. Texto 06 - Páginas 82 até 93.
Os autores do texto são: Arthur Auwerter e ?Miriam Goretti Stingelin Nepomoceno, Professores da Rede Estadual de Ensino do Paraná.
O texto é excelente, já trabalhei várias vezes. Como sugestão de atividade recomenda a atividade n° 03, que está postada neste blog, atividade interpretativa do texto, com a finalidade de exemplificar a aplicabilidade da Radioatividade e também servir de apoio teórico para o conteúdo estudado.
Sugestão de Vídeo: A descoberta da Radioatividade - youtube - Acesso em: 23/12/2010.
http://www.youtube.com/watch?v=5VvjBz-jbVc
DETALHAMENTO DAS EMISSÕES
Logo após a descoberta da radioatividade, os pesquisadores identificaram a emissão de particulas e ondas.
Um experimento fundamental foi realizado por Rutherford, que culminou também com o desenvolvimento de seu Modelo atômico em 1911.
Uma amostra de material radioativo é colocado dentro de uma caixa maciça que apresenta somente um orifício. Um campo elétrico é colocado na direção do orifício. As radiações emitidas pela amostra radioativa apresentam três direções de descolocamento, o que pode ser constatado colocando uma chapa fotográfica colocada perpendicular às placas metálicas.

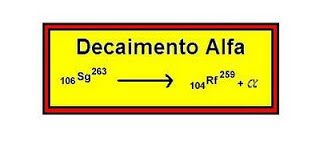
Radiações Alfa

As partículas alfa são constituídas de 2 prótons e 2 nêutrons, são semelhantes ao núcleo de um átomo do elemento Hélio.
Quando o núcleo do elemento radioativo emite radiação alfa seu núcleo perde 2 prótons e 2 nêutrons.
As partículas alfa possuem baixo poder de penetração, geralmente camadas externas de células mortas da pele conseguem parar as emissões alfa, sendo assim são consideradas emissões inofensivas, porém, se a pele apresentar algum tipo de ferimento ou forem inaladas, as lesões decorrentes podem ser graves. Exemplo de decaimento alfa.
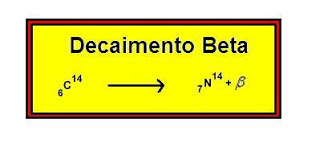
Radiações Beta

As partículas negativas, chamadas de radiação beta, são elétrons de origem nuclear emitidas em grande velocidade. Exemplo de decaimento beta:
Raios Gama
É uma forma de energia (energia eletromagnética), esse tipo de energia não se pertubavam com o campo elétrico do experimento descrito acima, foram denominadas então de gama e são ondas eletromagnéticas com a mesma natureza da luz, mas com frequencias muito altas, carregando enermes quantidades de energia, maiores que os raios X.
Ernest Rutherford - Nascido em Spring Grove, Nova Zelândia, 30 de Agosto de 1871 ? Cambridge, 19 de Outubro de 1937), Físico e Químico Neozelandês que se tornou conhecido como o ?Pai da Física Nuclear?.
?
MODELO ATÔMICO DE RUTHERFORD

Foi com o espalhamento de partículas alfa que, em 1911, que Rutherford chegou ao modelo atômico que deu origem à teoria quântica, nas mãos de Niels Bohr em extraordinário trabalho realizado em 1913. Sob o ponto de vista epistemológico, a história do projeto é magnífica. O início se deu ainda em Montreal, quando Rutherford percebeu que o feixe de raios alfa (ele ainda não sabia que se tratava de partículas) era mais disperso no ar do que no vácuo, levando-o a supor que se tratava da interação dos raios alfa com as partículas do ar. A partir daí ele começou a bombardear diferentes materiais com partículas alfa.Do Espalhamento de Partículas Alfa à Energia Nuclear: Caminhos Percorridos por Rutherford -
loading...
- Radioatividade
Radioatividade A foto foi retirada do arquivo de figuras da web. É um magnetar ou estrela de nêutrons que possui um poderoso campo magnético que emite para o espaço...
- História Da Radioatividade
Bolsista: Leidiane Rodrigues Rosa A radioatividade é definida como a capacidade que alguns elementos fisicamente instáveis possuem de emitir energia sob forma de partículas ou radiação eletromagnética.Após a descoberta da radioatividade...
- Modelo PlanetÁrio Do Átomo
Bolsista: Leidiane Rodrigues Rosa Falamos sobre um modelo atômico no post anterior: o da ?bola de bilhar?. Hoje vamos conhecer outro modelo: o modelo atômico de Rutherford, alguém conhece?Honrado como o pai da física nuclear, Ernest Rutherford foi...
- Leis Da Radioatividade - Exercícios Resolvidos
Exercícios de Fixação da Aprendizagem - Exercícios ResolvidosLeis da Radioatividade 1) Quando um dos isótopos do bismuto emite uma partícula alfa, há formação do Ti(A=210 e Z=81). Neste átomo pai, o número de prótons e o número...
- Atividade De QuÍmica N° 02 (tabela Z, A, P, N)
OLÁ ALUNOS! AS ATIVIDADES ABAIXO, DEVEM SER REALIZADAS EM FOLHA SEPARADA, NÃO ESQUECENDO DO CABEÇALHO COMPLETO DA INSTITUIÇÃO ESCOLAR QUE ESTÁ VÍNCULADO. BONS ESTUDOS.UM ABRAÇO DO PROF° RONALDO 1) Complete o quadro: ElementoZAPenCloro1735 ...
