Química
Obtenção do Sal KCl
A silvita é uma rocha, ou cristal mineral, composto basicamente por cloreto de potássio, cuja fórmula química é KCl, também a carnalita, outro mineral de fórmula química KClMgCI2 . 6 H2O, possui o KCl na sua fórmula química. O KCl também pode ser obtido pela reação da base hidróxido de potássio (KOH) com o ácido clorídrico (HCL).
- Flor De Sal
A flor de sal forma-se quando a evaporação na superfície é muito intensa e a camada superior da água fica sobressaturada. Não pode haver vento para não provocar o ?enrugamento? da superfície. Os cristais obtidos são muito frágeis e com uma...
- Ácido Benzóico
Bolsista: Ana Lucia Miranda Pertence ao grupo dos ácidos carboxílicos, é um composto aromático, seu nome oficial é ácido benzeno monocarboxílico. Foi descoberto no século XVI, é considerado o mais simples dos ácidos carboxílicos, por ser...
- Ácido ClorÍdrico (hcl)
Bolsista: Ana...
- Potássio (k)
...
- Exercícios Resolvidos - Funções Inorgânicas - Revisão De Conteúdo
Att. Verificamos que os comentários estão centrados na resolução dos exercícios!! Os exercícios não estão todos resolvidos, justamente, com uma finalidade didática, para que os estudantes pratiquem também a resolução. OK. ...
Química
Sais
Sais
A Definição Para os Sais
A Definição Para os Sais
Os sais são amplamente distribuidos na natureza e podem ser obtidos sinteticamente para o aproveitamento humano.São compostos iônicos, por esse motivo são bons condutores de corrente elétrica.
Quanto aos sais de Arrhenius, a sua formação se dá a partir da reação de um ácido com uma base de Arrhenius. Outra característica que alguns sais apresentam, é quando em contado com sensores do nosso paladar apresentam o sabor salgado, no entanto há sais com sabor amargo e há sais que não possuem sabor.
Quanto a sua obtenção, outros sais, além dos sais de Arrhenius, são obtidos diretamente da natureza na forma de cristais.
Quanto aos sais de Arrhenius, a sua formação se dá a partir da reação de um ácido com uma base de Arrhenius. Outra característica que alguns sais apresentam, é quando em contado com sensores do nosso paladar apresentam o sabor salgado, no entanto há sais com sabor amargo e há sais que não possuem sabor.
Quanto a sua obtenção, outros sais, além dos sais de Arrhenius, são obtidos diretamente da natureza na forma de cristais.
Exemplos de Alguns Sais Mais Comuns
Exemplificar numericamente os sais é bem complicado porque é grande o número das substâncias pertencentes a esse grupo. Aqui é descrito apenas uma limitada parte dos sais mais comuns, com os quais se pode contactar frequentemente.
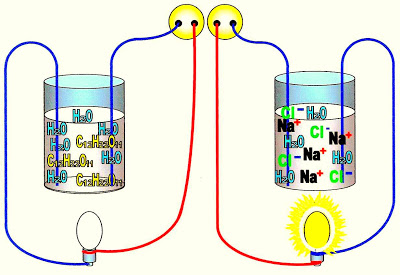
Os Sais e a Condução de Corrente Elétrica
NaCl - cloreto de sódio ? sal de cozinha |
KCl - cloreto de potássio |
NaCO3 - carbonato de sódio |
NaHCO3 - carbonato ácido de sódio |
FeSO4 - sulfato de ferro II |
CaO - óxido de cálcio |
CaSO4 - sulfato de cálcio |
BaSO4 - sulfato de bário |
MgSO4 - sulfato de magnésio |
CaCl2 - cloreto de cálcio |
CaCO3 - carbonato de cálcio |
Al2(SO4)3 - sulfato de alumínio |
Ca3(PO4)2 - difosfato de tricálcio |
CaHPO4 - fosfato ácido de cálcio |
CaHCO3 - carbonato ácido de cálcio |
KNO3 - nitrato de potássio |
NaNO3 - nitrato de sódio |
NaNO2 - nitrito de sódio |
CaOHCl - cloreto monobásico de cálcio |
ou monohidroxicloreto de cálcio |
K2S - sulfeto de potássio |
NaClO4 - perclorato de sódio |
KClO3 - clorato de potássio |
KClO 4 - perclorato de potássio |
AgNO3 - nitrato de prata |
Na2SO4 - sulfato dissódico |
NH4NO3 - nitrato de amônia |
CuSO4 - Sulfato de cobre |
CuSO3 - sulfito de cobre II ou sulfito cúprico |
K2HPO4 - hidrogenofosfato de potássio ou fosfato ácido de potássio |
KH2PO4 - hidrogenofosfato de potássio ou fosfato diácido de potássio |
MgO - óxido de magnésio |
KI - iodeto de potássio |
FeCO3 - carbonato ferroso |
Os Sais e a Condução de Corrente Elétrica

Os sais quando anidro ou na forma de cristais, não conduzem eletricidade. No entanto em solução aquosa dissociados em ânions e cátions, os sais são capazes de conduzir eletricidade (esquema acima).
Onde São Encontrados e Obtidos os Sais Mais Comuns
NaNO3 - Nitrato de sódio - salitre
O nitrato de sódio é encontrado no Chile em jazidas extensas , também no Egito e nos E.U.A., Argentina, Peru.
O NaNO3 é usado na produção de outro sal o nitrato de potássio que tem aplicações mais ou menos parecidas, é empregado na produção de explosivos e TNT, na medicina tem seu uso como regulador da pressão osmótica, na indústria química, na produção de vidro, na indústria metalúrgica, tem o seu emprego na fabricação de corantes, na preservação das carnes enlatadas para preservar a cor, sal é empregado como conservante de embutidos de carne, presunto, salame, mortadela, rosbife, bacon pode ser usado na preparação de propelente sólido de foguetes, ao ser combinado com hidróxido de ferro produz resina.
??O nitrato de sódio pode ser transformado por ação bacteriana a nitritos e perder a sua eficácia como conservante, principalmente da cor das carnes. Também esta presente no esmalte cerâmico de revestimento de peças de louças sanitárias e de mesas, isolantes elétricos etc.
| O carbonato de cálcio (CaCO3) é encontrado na casca dos ovos |
A silvita é uma rocha, ou cristal mineral, composto basicamente por cloreto de potássio, cuja fórmula química é KCl, também a carnalita, outro mineral de fórmula química KClMgCI2 . 6 H2O, possui o KCl na sua fórmula química. O KCl também pode ser obtido pela reação da base hidróxido de potássio (KOH) com o ácido clorídrico (HCL).
Na natureza, há vários outros cristais minerais, de onde pode ser obtido o potássio ou o cloreto de potássio.
??A Utilização Dos Sais Pelo Ser Humano
???????????
| O hipoclorito de sódio (NaClO) é um dos compostos iônicos amplamente utilizado na limpeza doméstica |
A Utilização do Cloreto de Sódio (NaCl)
O cloreto de sódio está presenta na preparação da nossa alimentação diária, na conservação de carenes secas, no soro fisiológico hospitalar a 0,9%. Utiliza-se o cloreto de sódio na eletrólise ígnea para se obter o metal sódio puro que é aplicado na produção da liga sódio/chumbo e para a fabricação de projéteis (balas), esse metal é muito importante na preparação da base hidróxido de sódio (NaOH), na purificação de metais fundidos, tem emprego na fabricação de células fotoelétricas, na fabricação de lâmpadas a vapor de sódio. Outro uso do cloreto de sódio é na obtenção do gás hidrogênio (H2) e gás cloro (Cl2) através da dissociação eletrolítica em água.
| Bicarbonato de sódio (NaHCO3) usado em extintor de incendio |
O Uso do Bicarbonato de Sódio (NaHCO3)
O carbonato ácido de sódio ou bicarbonato de sódio, é utilizado na preparação de bolos biscoitos, na medicina como anti ácido estomacal contras azias.
O Uso do Carbonato de Amônio (NH4)2CO3
Esse sal é utilizado como expectorante, em tingimento de tecidos, na produção de fermentos e nas fórmulas especiais de reveladores em tons quentes fotográficos, como ingrediente para shampoos, como agente de formação de espuma em material expandido (tipo isopor).
O Uso do Carbonato de Lítio Li2CO3
O carbonato de lítio pode se apresentar na forma de pó branco levemente alcalino e inodoro, é utilizado como medicamento antidepressivo, nos transtornos bipolares, mania recorrente e hiperatividade psicomotora. No entanto é muito tóxico, pessoas com problemas renais devem evitar esse medicamento a base de lítio, que pode também atingir a tireoide e causar hipotiroidismo. Além dessa aplicação o carbonato de lítio é utilizado como aditivo na produção do alumínio, na obtenção de hidróxido de lítio, na fabricação de vidro com alto teor de lítio que geralmente é a prova de fogo.
O Uso do Nitrato de Potássio (KNO3)
O nitrato de potássio pode ser utilizado como medicamento diurético, tem seu emprego como conservante de embutidos mortadela salame. O nitrato de potássio com açúcar comum pode ser um excelente combustível propelente de foguetes.
O Uso do Sulfato de ferro (II) (FeSO4)
O sulfato de ferro II é utilizado como medicamento antianêmico para as pessoas com anemia.
O Uso do Sulfato Ferroso Heptahidratado FeSO4 . 7 H2O
O sulfato ferroso heptahidratado (FeSO4 . 7 H2O), na categoria dos óxidos, ou sal inorgânico, é um pó de cor esverdeada, utilizado para produzir pigmentos das cores vermelha, preta, e amarela. Esse mesmo composto é também utilizado como floculante no tratamento e purificação de água, também pode ser empregado no tratamento de lixo.
O Uso do Cloreto de Potássio (KCl)
Cloreto de potássio é outro sal que é usado como xarope, mas também é utilizado como solução injetável 10% em solução fisiológica ou soro glicosado 5%. No organismo atua como eletrólito, ocupa o espaço intracelular promove o balanço eletrolítico dos ânions e cátions, além disso, trabalha no transporte osmótico ativo controlando a absorção e a perda de água, estabiliza o transporte iônico na membrana celular. É necessário na condução de impulsos nervosos do coração, cérebro e musculatura esquelética, mantem as funções renais equilibradas e o equilíbrio ácido-base do organismo.
Como medicamento, também atua no tratamento da hipocalemia, que é a baixa de potássio no organismo, age na alcalose metabólica, e serve para repor as perdas nas diarreias, ou quando ocorre perda do potássio no uso de diuréticos.
Ao usar esse sal, deve-se ter cuidados especialmente na insuficiência renal, pois pode haver o acúmulo da substância no organismo, deve-se também ter precaução na oligúria, diminuição ou ausência de produção de urína, por onde é excretado esse sal, outra preocupação é nas nefropatias, ou na desidratação aguda com hipovolumia, ou ainda quando um paciente ingere doses elevadas, que pode causar depressão cardíaca e até parada cardíaca. O aumento do sal no organismo pode causar confusão mental, interferir com o ritmo cardíaco e torná-los irregulares, um acúmulo orgânico pode ainda causar, dispneia (falta de ar); ansiedade, cansaço ou debilidade geral, o indivíduo pode sentir peso nas pernas,inchaço ou formigamento nas mãos, pés ou lábios.
A eliminação desse composto é feito 90% pela urina e o restante parte pelas fezes.
além do emprego como eletrólito é usado comercialmente como sal lighth adicionado ao cloreto de sódio atenua os efeitos do sódio no organismo, pro esse motivo é usado na alimentação. É aplicado na agricultura onde tem o seu emprego como fertilizante.
O Uso do Fluoreto de Sódio (NaF)
É utilizado como fungicida e inseticida, é utilizado no tratamento de madeiras como postes, dormentes, mourões de cercas das propriedades rurais, esteios e vigas para barracões e casas de madeira, até pouco tempo atrás era empregado na fluoretação da água potável, hoje por ser considerado um produto muito tóxico, foi banido esse uso, está presente nos cremes dentais e nos enxagues bucais, como agente preventivo de cáries dentárias.
Sulfato de Cálcio (CaSO4)
É utilizado na fabricação de giz, na fabricação do gesso empregado na construção civil, utilizado na ortopedia em fratura de ossos, o sulfato de cálcio di-hidratado em solução é utilizado como como adubo para plantas sendo fonte de íon Ca++ que favorece o crescimento.
A Solubilidade Dos Sais
O carbonato ácido de sódio ou bicarbonato de sódio, é utilizado na preparação de bolos biscoitos, na medicina como anti ácido estomacal contras azias.
O Uso do Carbonato de Amônio (NH4)2CO3
Esse sal é utilizado como expectorante, em tingimento de tecidos, na produção de fermentos e nas fórmulas especiais de reveladores em tons quentes fotográficos, como ingrediente para shampoos, como agente de formação de espuma em material expandido (tipo isopor).
O Uso do Carbonato de Lítio Li2CO3
O carbonato de lítio pode se apresentar na forma de pó branco levemente alcalino e inodoro, é utilizado como medicamento antidepressivo, nos transtornos bipolares, mania recorrente e hiperatividade psicomotora. No entanto é muito tóxico, pessoas com problemas renais devem evitar esse medicamento a base de lítio, que pode também atingir a tireoide e causar hipotiroidismo. Além dessa aplicação o carbonato de lítio é utilizado como aditivo na produção do alumínio, na obtenção de hidróxido de lítio, na fabricação de vidro com alto teor de lítio que geralmente é a prova de fogo.
O Uso do Nitrato de Potássio (KNO3)
O nitrato de potássio pode ser utilizado como medicamento diurético, tem seu emprego como conservante de embutidos mortadela salame. O nitrato de potássio com açúcar comum pode ser um excelente combustível propelente de foguetes.
O Uso do Sulfato de ferro (II) (FeSO4)
O sulfato de ferro II é utilizado como medicamento antianêmico para as pessoas com anemia.
O Uso do Sulfato Ferroso Heptahidratado FeSO4 . 7 H2O
O sulfato ferroso heptahidratado (FeSO4 . 7 H2O), na categoria dos óxidos, ou sal inorgânico, é um pó de cor esverdeada, utilizado para produzir pigmentos das cores vermelha, preta, e amarela. Esse mesmo composto é também utilizado como floculante no tratamento e purificação de água, também pode ser empregado no tratamento de lixo.
O Uso do Cloreto de Potássio (KCl)
Cloreto de potássio é outro sal que é usado como xarope, mas também é utilizado como solução injetável 10% em solução fisiológica ou soro glicosado 5%. No organismo atua como eletrólito, ocupa o espaço intracelular promove o balanço eletrolítico dos ânions e cátions, além disso, trabalha no transporte osmótico ativo controlando a absorção e a perda de água, estabiliza o transporte iônico na membrana celular. É necessário na condução de impulsos nervosos do coração, cérebro e musculatura esquelética, mantem as funções renais equilibradas e o equilíbrio ácido-base do organismo.
Como medicamento, também atua no tratamento da hipocalemia, que é a baixa de potássio no organismo, age na alcalose metabólica, e serve para repor as perdas nas diarreias, ou quando ocorre perda do potássio no uso de diuréticos.
Ao usar esse sal, deve-se ter cuidados especialmente na insuficiência renal, pois pode haver o acúmulo da substância no organismo, deve-se também ter precaução na oligúria, diminuição ou ausência de produção de urína, por onde é excretado esse sal, outra preocupação é nas nefropatias, ou na desidratação aguda com hipovolumia, ou ainda quando um paciente ingere doses elevadas, que pode causar depressão cardíaca e até parada cardíaca. O aumento do sal no organismo pode causar confusão mental, interferir com o ritmo cardíaco e torná-los irregulares, um acúmulo orgânico pode ainda causar, dispneia (falta de ar); ansiedade, cansaço ou debilidade geral, o indivíduo pode sentir peso nas pernas,inchaço ou formigamento nas mãos, pés ou lábios.
A eliminação desse composto é feito 90% pela urina e o restante parte pelas fezes.
além do emprego como eletrólito é usado comercialmente como sal lighth adicionado ao cloreto de sódio atenua os efeitos do sódio no organismo, pro esse motivo é usado na alimentação. É aplicado na agricultura onde tem o seu emprego como fertilizante.
O Uso do Fluoreto de Sódio (NaF)
É utilizado como fungicida e inseticida, é utilizado no tratamento de madeiras como postes, dormentes, mourões de cercas das propriedades rurais, esteios e vigas para barracões e casas de madeira, até pouco tempo atrás era empregado na fluoretação da água potável, hoje por ser considerado um produto muito tóxico, foi banido esse uso, está presente nos cremes dentais e nos enxagues bucais, como agente preventivo de cáries dentárias.
Sulfato de Cálcio (CaSO4)
É utilizado na fabricação de giz, na fabricação do gesso empregado na construção civil, utilizado na ortopedia em fratura de ossos, o sulfato de cálcio di-hidratado em solução é utilizado como como adubo para plantas sendo fonte de íon Ca++ que favorece o crescimento.
A Solubilidade Dos Sais
A Dissociação de Sais e a Geração De Ânions e Cátions
????
Um sal solúvel em água se dissocia liberando ânions e cátions.
A dissociação do cloreto de sódio em água.
 |
| O cloreto de sódio solúvel em água dissocia-se gerando o cátion sódio e o ânion cloro que ficam livres na solução aquosa. |
O sulfato de alumínio é um dos sais que se dissolvem em água. A dissociação do sulfato de alumínio em água, pode ser expressa pela equação:
 |
| O sulfato de alumínio dissocia-se formando cátions alumínio e ânions sulfato que ficam livres na solução aquosa. A representação da mesma dissociação do sulfato de alumínio em água fica: 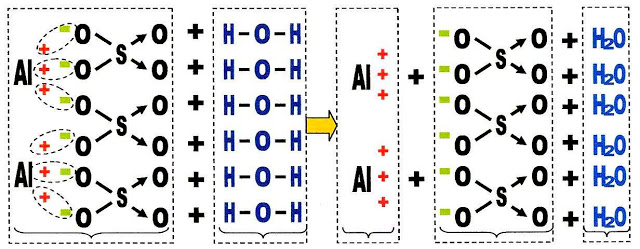 Solubilidade do Carbonato de Amônia (NH4)2CO3 O carbonato de amônio é muito solúvel solúvel em água fria. Solubilidade do Nitrato de Potássio O nitrato de potássio é muito solúvel em água. Solvente do Sulfato Ferroso FeSO4 . 7H2O O solvente para o sulfato ferroso heptahidratado é a água. Solubilidade do CaSO4 O sulfato de cálcio, principal componente do giz de lousa não é muito solúvel em água, a sua solubilidade é de apenas 2,0 gramas por litro de água na temperatura de 20ºC. |
A Formação de um Sal
A formação do sal cloreto de sódio (NaCl) envolvendo a base hidróxido de sódio e ácido clorídrico.
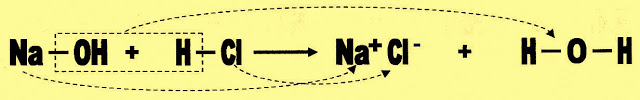 |
| Na reação o radical hidroxila da base e o radical hidrogênio do ácido formam a água e o cátion da base e o ânion do ácido formam o sal. |
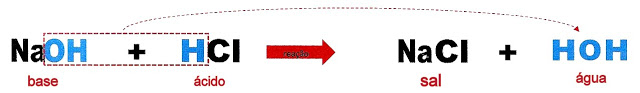
A Formação de um Sal Normal ou Neutro
A formação do sal cloreto de sódio (NaCl).
A base hidróxido de sódio reage com o ácido clorídrico gerando o cloreto de sódio e água.
Formação do nitrato de cálcio - sal neutro.

A mesma reação.
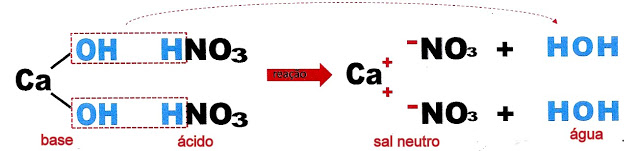 Outro exemplo de formação de sal normal:
Outro exemplo de formação de sal normal:
Para reagir com uma molécula de um triácido é necessário três moléculas da base hidróxido de sódio.
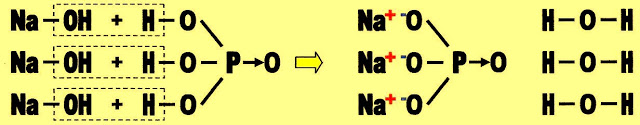
A formação do sal cloreto de sódio (NaCl).
A base hidróxido de sódio reage com o ácido clorídrico gerando o cloreto de sódio e água.

Formação do nitrato de cálcio - sal neutro.

A mesma reação.

Para reagir com uma molécula de um triácido é necessário três moléculas da base hidróxido de sódio.

Hidróxido de sódio ácido fosfórico fosfato de sódio água
Três moléculas de hidróxido de cálcio reagem com duas molécula de ácido fosfórico formando o sal fosfato de cálcio e seis moléculas de água.
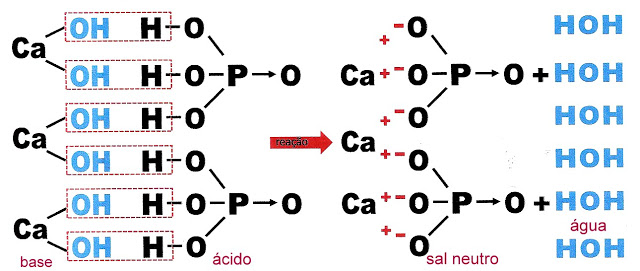
Ou a mesma reação:

A Formação de um Sal Ácido

Três moléculas de hidróxido de cálcio reagem com duas molécula de ácido fosfórico formando o sal fosfato de cálcio e seis moléculas de água.

Ou a mesma reação:

A Formação de um Sal Ácido
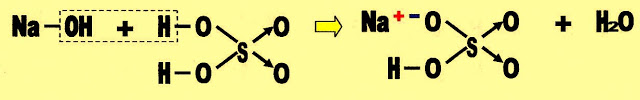
O sal ácido possui hidrogênio na sua fórmula. No sal ácido nem todos os hidrogênios são ionizados, é o que pode ser chamado de neutralização parcial do sal. Por exemplo: ao prepararmos uma solução de ácido sulfúrico com hidróxido de sódio de proporção 1 mol: 1 mol, podemos obter um sal ácido.

A mesma reação pode ser representada:

? Hidróxido de sódio ácido sulfúrico sulfato ácido de sódio água
A Formação de um Sal Básico
Sais básicos são formados a partir da reação parcial de uma base que possui mais de uma hidroxila na sua estrutura molecular, com um ácido de hidrogênio (s) ionizavel (is) a menos. Vejamos exemplo.
A formação do bicloreto monobásico de alumínio


Sais básicos são formados a partir da reação parcial de uma base que possui mais de uma hidroxila na sua estrutura molecular, com um ácido de hidrogênio (s) ionizavel (is) a menos. Vejamos exemplo.
A formação do bicloreto monobásico de alumínio

Hidróxido de alumínio ácido clorídrico bicloreto monobásico de alumínio água
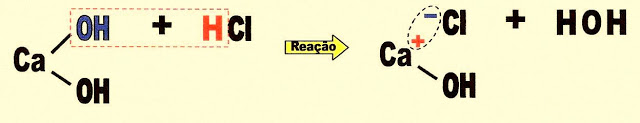
A formação do cloreto monobásico de cálcio.
A formação do cloreto monobásico de cálcio.


? hidróxido de cálcio ácido clorídrico cloreto monobásico de cálcio água
Sais Mistos
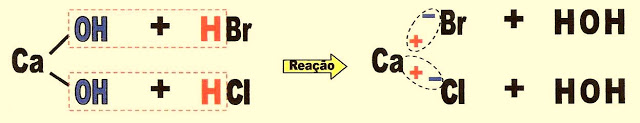

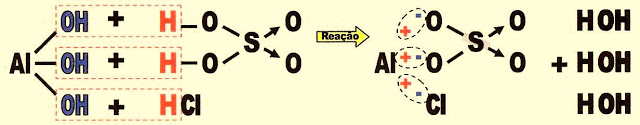

Os sais mistos podem ser formados por uma base e por dois ou mais ácidos diferentes. Por exemplo.
A formação do sal cloreto-brometo de cálcio.


hidróxido de cálcio ácido clorídrico ácido bromídrico cloreto-brometo de cálcio água
A formação do sal cloreto-sulfato de alumínio.


? hidróxido de alumínio ácido clorídrico ácido sulfúrico cloreto-sulfato de alumínio água
A Nomenclatura Dos Sais
Questões
1) Enem 2015 - Questão 47. Durante a aula, um professor apresentou uma pesquisa nacional que mostrava que o consumo de sódio pelos adolescentes brasileiros é superior ao determinado pela Organização Mundial da Saúde. O professor, então, destacou que esse hábito deve ser evitado.
a) obesidade.
b) osteoporose.
c) diabetes tipo II
d) hipertensão arterial.
e) hipercolesterolemia.
Bibliografia
Química - Ricardo Feltre - Química Geral Volume 1, Editora Moderna
6ª edição São Paulo 2004.
Química na Abordagem do Cotidiano TiTo & Canto Volume 1 Química Geral -Editora Moderna 2ª edição 1999.
Química O Homem e a Natureza - Química Geral, Volume 1. Geraldo Jose Covre editora FTD, São Paulo 2000.
Ser Protagonista Química - Ensino Médio, 1º ano. Organizadora Edições SM, São Paulo, 2ª edição 2013.
Sódio - Wikipedia, a enciclopédia livre
pt.wikipédia.org/wiki/
Francisco Miragaia Peruzzo, Eduardo Leita do Canto. Química na Abordagem do Cotidiano, Química Geral e Inorgânica, Volume 1, Editora Moderna 4ª edição, São Paulo 2010.
Carbonato de lítio - wikipédia, a enciclopédia livre
pt.wikipédia.org/wiki/carbonato_de_lítio
Agrominerais - Potássio - CETEM - Centro de Tecnologia
www.cetem.gov.br/agrominerais/livros/80-agrominerais-potássio.pdf
Eduardo Flaury Mortimer, Andréa Horta Machado. Química, Ensino médio manual do professor, 1ª Edição, Editora Scipione, São Paulo 2011.
Questões
1) Enem 2015 - Questão 47. Durante a aula, um professor apresentou uma pesquisa nacional que mostrava que o consumo de sódio pelos adolescentes brasileiros é superior ao determinado pela Organização Mundial da Saúde. O professor, então, destacou que esse hábito deve ser evitado.
a) obesidade.
b) osteoporose.
c) diabetes tipo II
d) hipertensão arterial.
e) hipercolesterolemia.
Bibliografia
Química - Ricardo Feltre - Química Geral Volume 1, Editora Moderna
6ª edição São Paulo 2004.
Química na Abordagem do Cotidiano TiTo & Canto Volume 1 Química Geral -Editora Moderna 2ª edição 1999.
Química O Homem e a Natureza - Química Geral, Volume 1. Geraldo Jose Covre editora FTD, São Paulo 2000.
Ser Protagonista Química - Ensino Médio, 1º ano. Organizadora Edições SM, São Paulo, 2ª edição 2013.
Sódio - Wikipedia, a enciclopédia livre
pt.wikipédia.org/wiki/
Francisco Miragaia Peruzzo, Eduardo Leita do Canto. Química na Abordagem do Cotidiano, Química Geral e Inorgânica, Volume 1, Editora Moderna 4ª edição, São Paulo 2010.
Carbonato de lítio - wikipédia, a enciclopédia livre
pt.wikipédia.org/wiki/carbonato_de_lítio
Agrominerais - Potássio - CETEM - Centro de Tecnologia
www.cetem.gov.br/agrominerais/livros/80-agrominerais-potássio.pdf
Eduardo Flaury Mortimer, Andréa Horta Machado. Química, Ensino médio manual do professor, 1ª Edição, Editora Scipione, São Paulo 2011.
Potássio - departamento Nacional de Produção Mineral
https://sistemas.dnpm.gpvbr/publicação/mostra_imagem.asp?...4004
Sulfato de cálcio Dihidratado PA - CaSO4.2H2O - 500 g
www.phbio.com.br/sulfato de cálciodihidratado
https://sistemas.dnpm.gpvbr/publicação/mostra_imagem.asp?...4004
Sulfato de cálcio Dihidratado PA - CaSO4.2H2O - 500 g
www.phbio.com.br/sulfato de cálciodihidratado
loading...
- Flor De Sal
A flor de sal forma-se quando a evaporação na superfície é muito intensa e a camada superior da água fica sobressaturada. Não pode haver vento para não provocar o ?enrugamento? da superfície. Os cristais obtidos são muito frágeis e com uma...
- Ácido Benzóico
Bolsista: Ana Lucia Miranda Pertence ao grupo dos ácidos carboxílicos, é um composto aromático, seu nome oficial é ácido benzeno monocarboxílico. Foi descoberto no século XVI, é considerado o mais simples dos ácidos carboxílicos, por ser...
- Ácido ClorÍdrico (hcl)
Bolsista: Ana...
- Potássio (k)
...
- Exercícios Resolvidos - Funções Inorgânicas - Revisão De Conteúdo
Att. Verificamos que os comentários estão centrados na resolução dos exercícios!! Os exercícios não estão todos resolvidos, justamente, com uma finalidade didática, para que os estudantes pratiquem também a resolução. OK. ...
