Química
Eletrólise
Eletrólise
A Eletrólise Ignea e a Obtenção de Substâncias Químicas
A Lei de Faraday
Em 1834 o físico-químico Michael Faraday, baseando-se em estudos experimentais propôs a seguinte lei: a massa de uma substância produzida, ou consumida, em reações eletrolíticas é diretamente proporcional à intensidade da corrente (i) e ao tempo (t) da passagem da corrente pelo eletrólito.
A Carga Elétrica Necessária Para se Obter 1 Equivalente-grama Dessas Substâncias
Equivalente-grama

Equivalente - grama dos Cátions
Equivalente-grama do sódio
 O equivalente - grama do átomo de alumínio é 9 gramas.
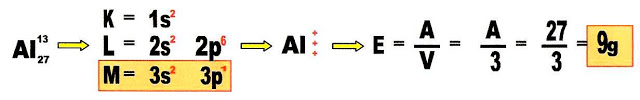
O equivalente - grama do átomo de alumínio é 9 gramas.
 O equivalente - grama do cloro é 35,5 g.
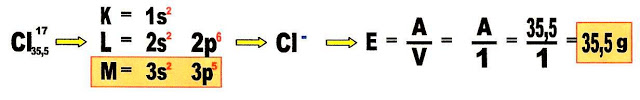
O equivalente - grama do cloro é 35,5 g.
A Carga Elétrica Para o Equivalente - grama




Eletrolise Ígnea e Obtenção de Metais.
Com a eletrólise ígnea obtém-se metais da família A, como o sódio (Na) da família 1A, magnésio (Mg) da família 2A, alumínio (Al) da família do boro. O gás cloro (Cl2) também pode ser obtido pela eletrólise ígnea.
Obtenção de Sódio Metálico
Segundo esquema.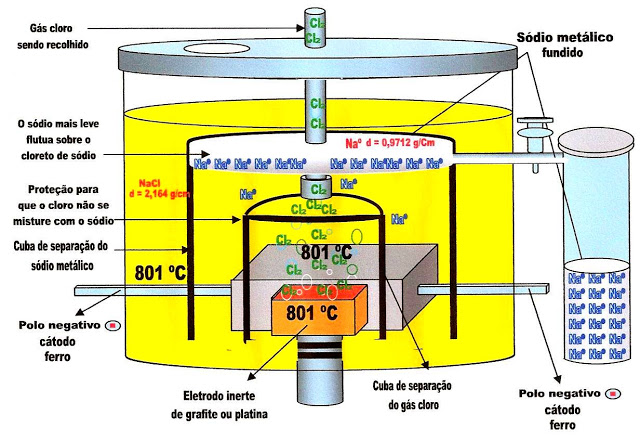
- Metais
Metais Metais - Definição Os metais são sólidos, (com exceção...
- Ligação Iônica
A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron....
- Aula Prática De Laboratório
Ensino Médio - Primeiras Séries A, B, C, 1TA, 1TB ...
- Oxidação E Redução
Bolsista: Loys Laynne Rodrigues Sousa Oi pessoal, hoje vamos falar sobre oxidação e redução, também chamados de oxirredução, oxi-red ou redox, esses fenômenos são um dos mais importantes na química e um dos mais freqüentes...
- Sódio (na)
Bolsista: Leonice Paraguai Olá pessoal! Estou de volta para falar um pouco mais de outro "Elemento Químico". Hoje vou falar do elemento Sódio (Na), é um elemento muito usado no nosso cotidiano, está presente em nossa vida, no nosso corpo, juntando-se...
Química
Eletrólise
Eletrólise
Eletrólise
A eletrólise de um modo geral é caracterizada por ser um processo de oxirredução ou de obtenção de íons livres com a ajuda de corrente elétrica.
A eletrólise Ígnea pode ser definida como oxirredução ou descarga iônica que necessita de energia elétrica aplicada para ser realizada. É o processo de se obter íons livres aplicando temperatura de fusão e corrente elétrica de alta voltagem. Conclui-se portanto que na eletrólise deve haver íons livres.
Eletrólise - Transformação Química
O processo da eletrólise é um processo de transformação química com o consumo de energia elétrica. Se presta á obtenção de material puro como por exemplo um metal que esteja em solução ou fundido, pelo uso de corrente elétrica.
Também podemos explicar a eletrólise com um simples experimento, o da palha de aço mergulhada na solução de sulfato de cobre. Nesse experimento fazemos uma solução de sulfato de cobre CuSO4 1 molar e mergulhamos a palha de aço nessa solução, esperamos alguns minutos e observamos que a solução de sulfato de cobre de cor azul fica incolor, enquanto a palha de aço adquire a cor castanha do cobre.
Porque Isso Acontece?
Eletrólise - Transformação Química
O processo da eletrólise é um processo de transformação química com o consumo de energia elétrica. Se presta á obtenção de material puro como por exemplo um metal que esteja em solução ou fundido, pelo uso de corrente elétrica.
Também podemos explicar a eletrólise com um simples experimento, o da palha de aço mergulhada na solução de sulfato de cobre. Nesse experimento fazemos uma solução de sulfato de cobre CuSO4 1 molar e mergulhamos a palha de aço nessa solução, esperamos alguns minutos e observamos que a solução de sulfato de cobre de cor azul fica incolor, enquanto a palha de aço adquire a cor castanha do cobre.
Porque Isso Acontece?
Isso acontece porque na solução de sulfato de cobre há o cobre oxidado Cu2+ enquanto que os elétrons desse cobre migram para a palha de aço, (ferro Feº reduzido), que fica como que "eletrificada". O cobre oxidado Cu2+ oxidado, também migra para a palha de aço atrás desses elétrons e se fixa na palha de aço tornando se cobre metálico reduzido Cuº. Essa transformação seria um tipo processo de eletrodeposição mais grosseira.
Nesse caso não se usa corrente elétrica e nem ocorre consumo de energia, a reação é expontânea.
Dados de conhecimentos necessários aos cálculos de eletrólise.
1 C = 6,25 x 1018 elétrons.
1 elétron = 1,609 x 10-19 C.
Qual é a carga elétrica de 1 C ?
1 C = 1,609 x 10-19 x 6,25 x 1018.
1 C = 10,056 x 10-1 = 1,0056 Q.
1 C = 1 A ou 1 A = 1 C/s.
1 V = 6,025 x 1018 elétrons.
1 V = 1 A = 1 C.
1 mol de elétrons = 6,02 x 1023elétrons.
1 mol de elétrons = 96500 C.
96500 C = 6,02 x 1023 x 1,609 x 10-19 = 9,6861 x 104 = 96861 C que coincide aproximadamente com 96500 C.
1 faraday = 96500 C
1 faraday = 96500 C
A Eletrólise Ignea e a Obtenção de Substâncias Químicas
A Lei de Faraday
Em 1834 o físico-químico Michael Faraday, baseando-se em estudos experimentais propôs a seguinte lei: a massa de uma substância produzida, ou consumida, em reações eletrolíticas é diretamente proporcional à intensidade da corrente (i) e ao tempo (t) da passagem da corrente pelo eletrólito.
As substâncias químicas que podemos obter pela eletrólise ígnea são: o Sódio metálico (Na), e o cloro molecular ou gás cloro (Cl2) que sai na eletrólise do cloreto de sódio, o alumínio puro extraído pela eletrólise ígnea da bauxita ou alumina (Al2O3) o magnésio metálico a partir do cloreto de magnésio MgCl2, o lítio metálico a partir do cloreto de lítio (LiCl) etc. A eletrólise ígnea é usada também na galvanoplastia que estudaremos mais á frente.
Equivalente-grama
Primeiramente deveremos entender o que é equivalente-grama de um modo geral, assunto também abordado no capítulo de soluções químicas.
Definimos equivalente ? grama como quociente do elemento químico (A) dividido pela valência (V) do elemento.

Equivalente - grama dos Cátions
Equivalente-grama do sódio
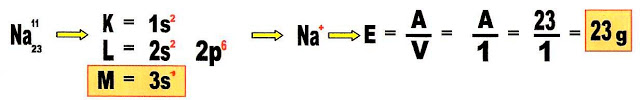
Vejamos exemplos: qual é o equivalente-grama do elemento químico sódio (Na)?
Achamos a valência do sódio, depois dividimos a sua massa pela valência e obtemos o equivalente - grama. O sódio termina com 1 elétron na distribuição eletrônica, então sua configuração como íon, é o cátion Na+.

O equivalente - grama do átomo de sódio é 23 gramas.
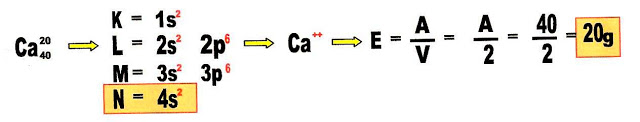
Equivalente-grama do cálcio.
Equivalente-grama do cálcio.
Achamos a valência do cálcio pela distribuição eletrônica, a distribuição eletrônica termina com dois elétrons na última camada, então sua configuração como íon é o cátion Ca2+ então a valência do cálcio é 2. como equivalente-grama é a massa dividida pela valência:

O equivalente - grama do átomo de cálcio é 20 gramas.
Equivalente-grama do Alumínio
Qual é o equivalente-grama do elemento químico alumínio (Al)?Equivalente-grama do Alumínio

Equivalente-grama para ânion
Qual é o equivalente-grama para o ânion cloro?

A Carga Elétrica Para o Equivalente - grama
Um equivalente ? grama de sódio metálico, que corresponde a 23 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Um equivalente ? grama de cálcio que corresponde a 20 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Um equivalente ? grama de alumínio metálico, que corresponde a 9,0 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Um equivalente ? grama de cloro que corresponde a 35,5 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Para entendermos melhor a eletrólise, devemos ter a noção básica sobre o que é oxirredução. Um equivalente ? grama de alumínio metálico, que corresponde a 9,0 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Um equivalente ? grama de cloro que corresponde a 35,5 gramas desse elemento químico, necessita de 96500 Coulomb de carga elétrica para ser obtido.
Número de Elétrons Implicados Na Carga
A carga de 1 elétron é de 1,602189 x 10-19 Coulomb.
Para se obter a carga elétrica de 96500 Coulomb, quantos elétrons serão necessários?
O número de elétrons em Coulomb é dado pela expressão:
Carga total em C 96500 23
Número de elétrons = ------------------------------ = --------------------- = 6,02 x 10 elétrons.
carga de um elétron 1,602189 x 10-19
Obs: como o número de elétrons que fornece a energia da transformação deve ser positivo, positivamos esse valor numérico para que faça sentido.
A carga de 1 elétron é de 1,602189 x 10-19 Coulomb.
Para se obter a carga elétrica de 96500 Coulomb, quantos elétrons serão necessários?
O número de elétrons em Coulomb é dado pela expressão:
Carga total em C 96500 23
Número de elétrons = ------------------------------ = --------------------- = 6,02 x 10 elétrons.
carga de um elétron 1,602189 x 10-19
Obs: como o número de elétrons que fornece a energia da transformação deve ser positivo, positivamos esse valor numérico para que faça sentido.
Para se obter 23,0 gramas de sódio metálico há a necessidade da aplicação de uma carga elétrica de 96500 Coulomb que é composta de 6,02 x 1023 elétrons.
9) Quantos elétrons são movimentados para se conseguir uma carga elétrica em Coulomb que possibilite produzir:
a) 23,0 g de sódio (Na) metálico? g) 0,71875 g de sódio (Na) metálico?
b) 11,5 g de sódio (Na) metálico? h) 46,0 g de sódio (Na) metálico?
c) 5,75 g de sódio (Na) metálico? i) 69,0 g de sódio (Na) metálico?
d) 2,875 g de sódio (Na) metálico? j) 92,0 g de sódio (Na) metálico?
e) 1,4375 g de sódio (Na) metálico? k) 115,0 g de sódio (Na) metálico?
f) 1,0 g de sódio (Na) metálico? l) 150,0 g de sódio (Na) metálico?
Massa de Na em g | Carga elétrica em Coulomb | Nº elétrons que participam | |||||
a) | 0,718 | = | 3012,48 | = | 0,19 x 1023 | ||
b) | 1,44 | = | 6041,74 | = | 0,37 x 1023 | ||
c) | 2,87 | = | 12041,52 | = | 0,75 x 1023 | ||
d) | 5,75 | = | 24125,00 | = | 1,50 x 1023 | ||
e) | 11,50 | = | 48250,00 | = | 3,01 x 1023 | ||
f) | 17,50 | = | 72375,00 | = | 4,58 x 1023 | ||
g) | 23,00 | = | 96500,00 | = | 6,02 x 1023 | ||
h) | 25,87 | = | 108541,50 | = | 6,77 x 1023 | ||
i) | 34,50 | = | 144750,00 | = | 9,03 x 1023 | ||
j) | 46,00 | = | 193000,00 | = | 12,04 x1023 | ||
k) | 50,00 | = | 209782,60 | = | 13,08 x 1023 | ||
l) | 69,00 | = | 289500,00 | = | 18,06 x 1023 | ||
m) | 92,00 | = | 386000,00 | = | 24,08 x 1023 | ||
n) | 115,00 | = | 482500,00 | = | 30,10 x 1023 | ||
o) | 125,00 | = | 524456,00 | = | 32,71 x 1023 | ||
p) | 150,00 | = | 629347,82 | = | 39,26 x 1023 | ||
q) | 175,00 | = | 734239,13 | = | 45,80 x 1023 | ||
r) | 200,00 | = | 839130,48 | = | 52,34 x 1023 |
2) (adaptado). Na eletrólise para obtenção de prata Agº, é utilizada a solução de AgNO3 (nitrato de prata), utilizando uma carga de 965 coulombs que passa pela solução. Pergunta-se: qual é a massa de prata que o cátodo pode liberar nessa reação?
Massa do Ag = 108 g/mol.
Ag+ + 1 é ............... Agº
1mol 1 mol
1 mol é .....................1 mol de Ag.
96500 C .................108 g Ag 965 x 108 Ag 104220
X = ____________ ______ = 1,08 g Ag
965 C ................. X 96500 96500
3) (adaptado) Ao utilizar a solução de AlF3 (fluoreto de alumínio) fundido na eletrólise, pergunta-se: qual é a massa de Alº (alumínio) é obtida pelo cátodo, ao passar uma carga de 3860 coulombs por essa solução?
Massa do alumínio = 27 g/mol
Al3+ + 3é ..................Alº
3 mol 1 mol
3 mol de é ------------ 1 mol de Al
3 x 96500 C ------------ 27 g de Al 3860 x 27 g/Al 104220
X = ---------------------- = ---------- = 0,36 g Al
3860 C ------------ X 289500 289500
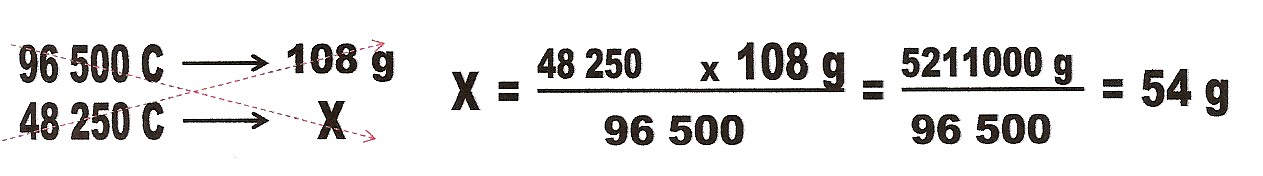
Massa do Ag = 108 g/mol.
Ag+ + 1 é ............... Agº
1mol 1 mol
1 mol é .....................1 mol de Ag.
96500 C .................108 g Ag 965 x 108 Ag 104220
X = ____________ ______ = 1,08 g Ag
965 C ................. X 96500 96500
3) (adaptado) Ao utilizar a solução de AlF3 (fluoreto de alumínio) fundido na eletrólise, pergunta-se: qual é a massa de Alº (alumínio) é obtida pelo cátodo, ao passar uma carga de 3860 coulombs por essa solução?
Massa do alumínio = 27 g/mol
Al3+ + 3é ..................Alº
3 mol 1 mol
3 mol de é ------------ 1 mol de Al
3 x 96500 C ------------ 27 g de Al 3860 x 27 g/Al 104220
X = ---------------------- = ---------- = 0,36 g Al
3860 C ------------ X 289500 289500
4) (UFS-SE) (adaptado) Sabendo que 1 mol de elétrons coincide com 96500 C, numa experiência em uma célula eletrolítica, utilizando a solução de nitrato de prata (AgNO3) passou-se uma corrente elétrica de 5 A, durante 9 650 s pergunta-se: quantas gramas de prata metálica foi obtido?
Dados: Ag = 108 g/mol. Q = carga elétrica.
A quantidade de eletricidade que fluiu pela célula foi: i = intensidade da corrente.
Q = i . ?t = 5,0 . 9 650 s = 48 250 C/s.
A equação da redução da prata é:
Ag+ + e- ? Ag?
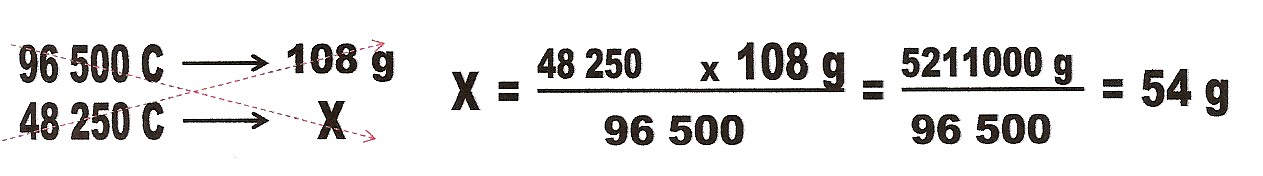
5) (Ufes) (adaptado) Em uma solução de eletrólise em solução de níquel, uma corrente elétrica que passa por um eletrodo, permite ocorrer a reação:
Ni2+ + 2 e- ? Ni?(s)
Pede-se: calcular a carga em Coulomb, necessária na obtenção de 0,5 mol de níquel metálico.
Como:1 mol de níquel = 59,0 g .
O equivalente -grama do níquel é a sua massa dividida pela bivalência, devemos duplicar a energia gasta para a produção de um mol do metal.
O equivalente -grama do níquel é a sua massa dividida pela bivalência, devemos duplicar a energia gasta para a produção de um mol do metal.
Ni2+ + 2 e- -------------? Ni?(s)
2 mol 1 mol
2 x 6,02 x1023 elétrons 59,0 g de Ni?
Como: 96500 C produz somente 28,5 g Ni?
Voltando a mesma reação acima:
Ni2+ + 2 e- -------------? Ni?(s)
2 mol 1 mol
2 x 96500 C 59,0 g de Ni?
Então para produzir 0,5 mol de níquel metálico, é necessário a carga de 96500 C, para produzir as 28,5 g Ni?.
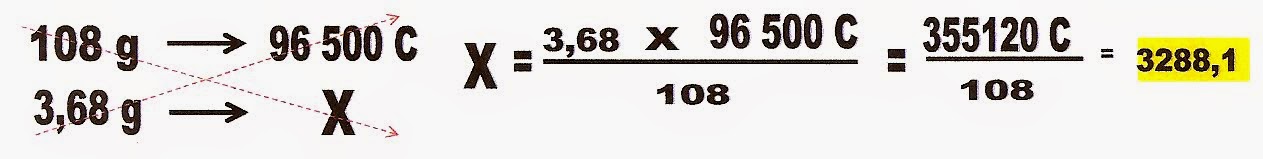

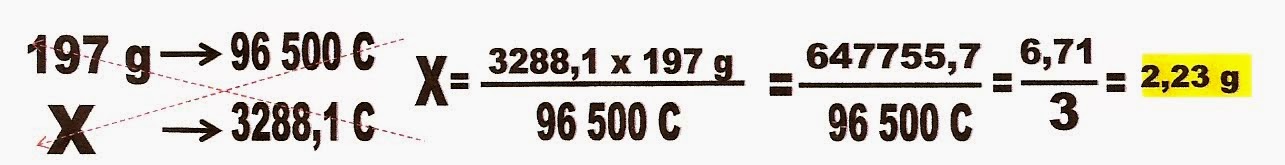
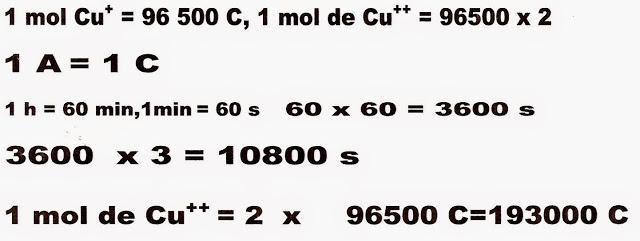

6) (Uece) (adaptado) A questão pergunta a quantidade de massa obtida dos seguintes metais; ouro e cobre , quando se faz passar uma corrente elétrica por uma cuba eletrolítica disposta em série, onde estão contidas as soluções desses metais Ag+, Cu2+, Au3+. Dado; que a massa obtida da prata foi de 3,68 g.
Para resolução dessa questão há vários modos. Você poderá solucionar o problema, começando por calcular a carga elétrica aplicada nas soluções.
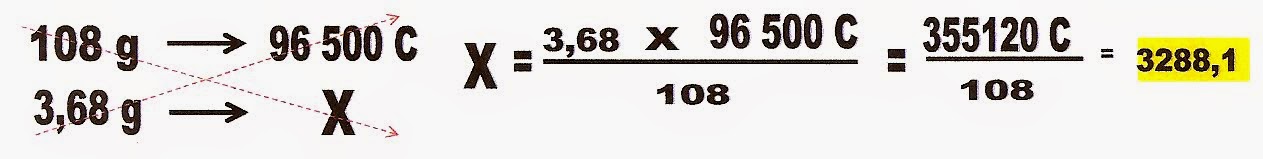
Após calcular a carga elétrica você calcula a massa do cobre obtida.

Calcula-se também a massa de ouro obtida.
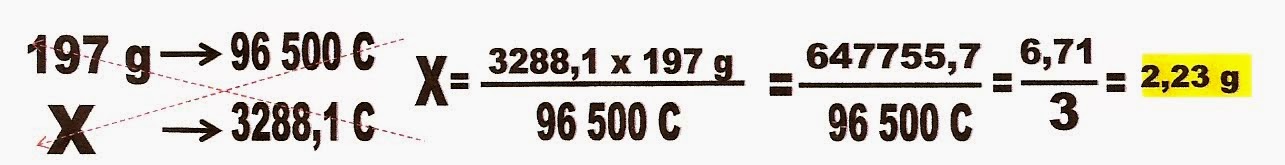
7) (Enem) A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9% . Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre II (CuSO4) durante 3 h, empregando-se uma corrente elétrica de intensidade igual a 10 A. A massa de cobre puro recuperada é de aproximadamente:
Dados: Constante de Faraday F = 96500 C/mol.
Massa molar em g/mol: Cu = 63,5.
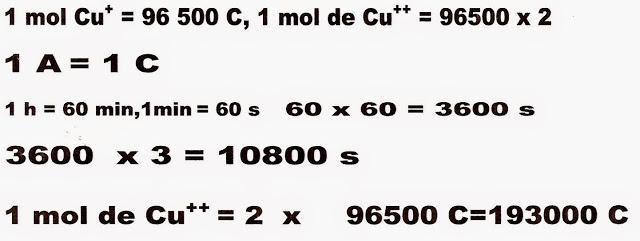

8) No processo de eletrólise do alumínio, quais as cargas em coulomb correspondem as
seguintes massas de alumínio obtidas.
a) | = | ||
b) | = | ||
c) | = | ||
d) | = | ||
e) | = | ||
f) | = | ||
g) | = | ||
h) | = | ||
i) | = | ||
j) | = | ||
k) | = | ||
l) | = |
9) Quantos elétrons são movimentados para se conseguir uma carga elétrica em Coulomb que possibilite produzir:
a) 23,0 g de sódio (Na) metálico? g) 0,71875 g de sódio (Na) metálico?
b) 11,5 g de sódio (Na) metálico? h) 46,0 g de sódio (Na) metálico?
c) 5,75 g de sódio (Na) metálico? i) 69,0 g de sódio (Na) metálico?
d) 2,875 g de sódio (Na) metálico? j) 92,0 g de sódio (Na) metálico?
e) 1,4375 g de sódio (Na) metálico? k) 115,0 g de sódio (Na) metálico?
f) 1,0 g de sódio (Na) metálico? l) 150,0 g de sódio (Na) metálico?
Resolução
a) 23,0 g de Na metálico movimenta a carga de 96500 Coulomb que proporciona o deslocamento de 6,02 x 1023 elétrons de um eletrodo para o outro.
b) 11,5 g Na
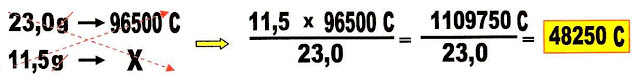
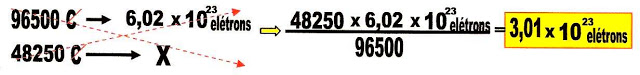
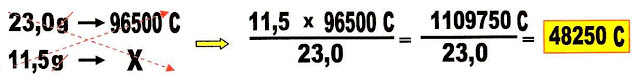
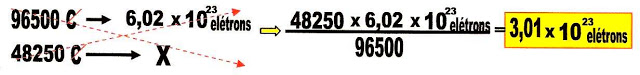
Oxidação é o processo de doação de elétron (s) por uma partícula ou elemento químico.
Redução é o processo em que a partícula ou elemento químico recebe elétron (s).
Observemos a expressão:

Cloreto de sódio sódio redutor cloro oxidante

O sódio doou o cloro recebeu
elétron oxidou elétron ficou reduzido
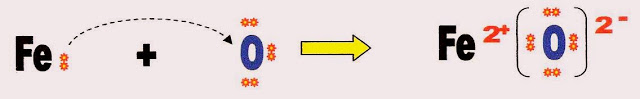
Vejamos a reação do ferro com o oxigênio para formar óxido de ferro.

Ferro oxigênio
oxidado reduzido
Eletrólise Ígnea
É usada para obtenção de metais alcalinos, metais alcalinos terrosos e outros como o alumínio pertencente a coluna 13 e dos halogênios pertencentes a coluna 17 da tabela periódica.
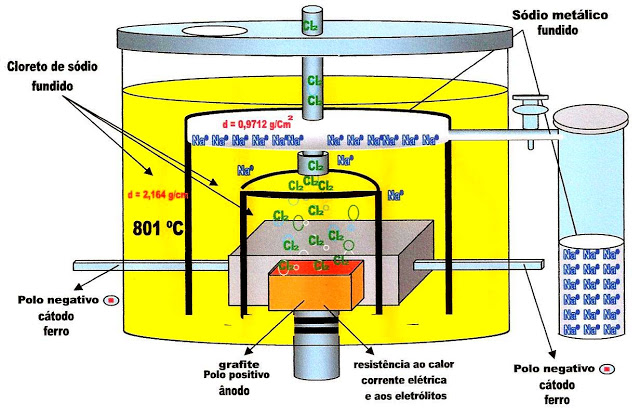
O exemplo mais comum para entendermos a eletrólise ígnea é utilizando o sal de cozinha (cloreto de sódio).
O cloreto de sódio é submetido a uma temperatura de 801 ºC, se liquefaz, libera o cátion sódio e o ânion cloro no estado líquido.

Em seguida esses íons aquecidos e no estado líquido é submetido a uma corrente elétrica contínua de alta voltagem, que promove a liberação separada do sódio metálico (Na) e do gás cloro (Cl2).

Eletrolise Ígnea e Obtenção de Metais.
Com a eletrólise ígnea obtém-se metais da família A, como o sódio (Na) da família 1A, magnésio (Mg) da família 2A, alumínio (Al) da família do boro. O gás cloro (Cl2) também pode ser obtido pela eletrólise ígnea.
Obtenção de Sódio Metálico
Esquema para a separação do sódio metálico e gás cloro a partir da solução de cloreto de sódio pelo processo de eletrólise.

Segundo esquema.

Utilização do Sódio Metálico
O sódio metálico deve ser guardado imerso em querozene ou hexano, em contato com o ar ou água, reage fortemente gaseificando-se e explodindo. É utilizado na produção da liga metálica de sódio e chumbo, usada na confecção de balas ou projéteis de armas de fogo. Antigamente era utilizado na preparação de antidetonante adicionado á gasolina, como mistura de chumbo e sódio, atualmente abandonado esse uso devido o chumbo ser metal pesado, altamente tóxico e contaminante ambiental. O sódio é utilizado na fabricação de produtos de limpeza, na mistura, sódio mais ácidos graxos produzindo o detergente.
Tem seu uso na purificação de metais fundidos.
Na produção de metais fundidos como por exemplo, o alumínio (Al) metálico: que na sua segunda faze de produção, a digestão, é feita com a soda caustica, e na sua fase seguinte de fundição, também é utilizada a criolita, mineral que contem sódio e é capaz de baixar a temperatura de fusão da alumina de 2000ºC para 1000ºC.
É utilizado na fabricação de células fotoelétricas, no caso do sódio essas células são lampadas de sódio.
Tem seu emprego na fabricação de lâmpadas a vapor de sódio, na produção de borrachas na qual o sódio entra como catalisador, na produção de peróxido de sódio e cianeto de sódio que é usado na mineração de ouro e prata, substituindo o mercúrio.
O sódio metálico deve ser guardado imerso em querozene ou hexano, em contato com o ar ou água, reage fortemente gaseificando-se e explodindo. É utilizado na produção da liga metálica de sódio e chumbo, usada na confecção de balas ou projéteis de armas de fogo. Antigamente era utilizado na preparação de antidetonante adicionado á gasolina, como mistura de chumbo e sódio, atualmente abandonado esse uso devido o chumbo ser metal pesado, altamente tóxico e contaminante ambiental. O sódio é utilizado na fabricação de produtos de limpeza, na mistura, sódio mais ácidos graxos produzindo o detergente.
Tem seu uso na purificação de metais fundidos.
Na produção de metais fundidos como por exemplo, o alumínio (Al) metálico: que na sua segunda faze de produção, a digestão, é feita com a soda caustica, e na sua fase seguinte de fundição, também é utilizada a criolita, mineral que contem sódio e é capaz de baixar a temperatura de fusão da alumina de 2000ºC para 1000ºC.
É utilizado na fabricação de células fotoelétricas, no caso do sódio essas células são lampadas de sódio.
Tem seu emprego na fabricação de lâmpadas a vapor de sódio, na produção de borrachas na qual o sódio entra como catalisador, na produção de peróxido de sódio e cianeto de sódio que é usado na mineração de ouro e prata, substituindo o mercúrio.
loading...
- Metais
Metais Metais - Definição Os metais são sólidos, (com exceção...
- Ligação Iônica
A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron....
- Aula Prática De Laboratório
Ensino Médio - Primeiras Séries A, B, C, 1TA, 1TB ...
- Oxidação E Redução
Bolsista: Loys Laynne Rodrigues Sousa Oi pessoal, hoje vamos falar sobre oxidação e redução, também chamados de oxirredução, oxi-red ou redox, esses fenômenos são um dos mais importantes na química e um dos mais freqüentes...
- Sódio (na)
Bolsista: Leonice Paraguai Olá pessoal! Estou de volta para falar um pouco mais de outro "Elemento Químico". Hoje vou falar do elemento Sódio (Na), é um elemento muito usado no nosso cotidiano, está presente em nossa vida, no nosso corpo, juntando-se...
