Química

- Química Orgânica - Alcenos
Alcenos Alcenos ou...
- O Que Usar? Acetona Ou Removedor?
Bolsista: Eliana Carvalho Olá queridos amigos leitores da Química da Beleza!Hoje nossa curiosidade é saber qual composto agride menos a unha quando precisamos retirar o esmalte. E para isto há...
- Ácido Acético (ch3ooh)
Bolsista: Ana Lucia Miranda Este ácido também é conhecido como etanoico, é da família dos ácidos carboxílicos, tendo dois carbonos em sua estrutura, é habitualmente encontrado na forma impura como vinagre, em soluções aquosas ele é um ácido...
- Acetonas
Bolsista Eliana A acetona usada para retirar os esmaltes é um solvente líquido incolor, inflamável, de cheiro agradável e solúvel em água e em solventes orgânicos. Ela é preparada industrialmente por...
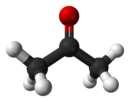
- Alcenos - Função Hidrocarboneto
O texto abaixo foi extraído da página Química Nova Interativa: http://qnint.sbq.org.br/qni/visualizarMolecula.php?idMolecula=163 O eteno, fórmula molecular C2H4, 28.03 g.mol-1, é um gás incolor à temperatura ambiente e pressão...
Química
ENCOLHENDO ISOPOR
Bolsista: Solange Batista de Sousa Anacleto Reis

MATERIAIS UTILIZADOS
- Isopor
- Copos descartáveis de poliestireno (código de reciclagem 6)
- Acetona (comprado em farmácias como removedor de esmalte)
- Frasco de vidro de boca larga
PROCEDIMENTOS
- Coloque alguns mililitros de acetona no frasco de vidro de boca larga
- Vá colocando aos poucos os pedaços de isopor e observe a reação.
- Pode colocar também pedaços de copo descartável ou uma embalagem de poliestireno e observar o que ocorrerá após algum tempo.
CUIDADO: A acetona é inflamável, portanto verifique se não há fonte calor ou chamas por perto, pois pode ser perigoso.
PORQUE ACONTECEU ESSA REAÇÃO?
O isopor é formado por um polímero conhecido como poliestireno, que tem o código de reciclagem 6, que nos mostra então que ele pode ser reciclado. Essa reciclagem já ocorre em muitos lugares, transformando-o em caixas de fita cassetes e vasos de plantas.
Na fabricação do isopor, o polímero é formado na presença de um solvente com um baixo ponto de ebulição que, ao evaporar, expande o plástico, deixando entrar o ar na sua estrutura. O isopor contém cerca de 95% de ar em sua composição. Esse ar, o torna um excelente isolante térmico.
Inicialmente o solvente usado para expandir o isopor eram os CFCs (Clorofluorcarbonos), mas devido aos problemas causados por ele à camada de ozônio, eles foram substituídos por solventes que não agridem o meu ambiente.
No nosso experimento podemos notar que ao colocarmos o isopor e o copo descartável na acetona, surgem algumas bolhas. Isso acontece porque a acetona enfraquece as interações entre as cadeias de poliestireno, amolecendo o isopor e permitindo que o ar preso escape.
FALANDO UM POUQUINHO SOBRE:
- ACETONA ? Também conhecida como dimetilcetona, 2-propanona, propan-2-ona ou simplesmente propanona. É um composto orgânico sintético que também ocorre naturalmente no meio ambiente. É um líquido incolor de odor e sabor fáceis de distinguir. A acetona é produzida principalmente por processos de desidrogenação ou peroxidação do álcool isopropanol. Uma das formas de se obter a acetona é pela oxidação do álcool secundário 2-propanol (isopropanol), utilizando uma mistura de dicromato de potássio (K2Cr2O7) ou ácido sulfúrico concentrado (H2SO4). Outro método consiste no aquecimento a 300ºC do acetato de cálcio. Aproximadamente 80% da acetona é produzida como um co-produto do fenol.

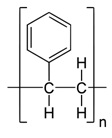
- POLIESTIRENO -Originário da reação de etileno com benzeno na presença de cloreto de alumínio, obtendo-se o etilbenzeno, que hidrogenado forma o estireno. Sua produção comercial se deu no ano de 1938, sendo descoberto pela primeira vez em 1839 pelo farmacêutico alemão Eduard Simon. O monômero para a produção do poliestireno é o estireno, que quimicamente é um hidrocarboneto aromático insaturado, também chamado de difenilacetileno ou vinilbenzeno.É um líquido, com ponto de ebulição 145ºC e ponto de solidificação -30,6ºC.Quando puro é incolor e apresenta um odor agradável e adocicado.Pode ser obtido industrialmente a partir de vários processos, entretanto o mais utilizado consiste na desidrogenação do etil-benzeno, sendo este obtido a partir da alquilação do benzeno por reação com o etileno, na presença de um catalisador como o cloreto de alumínio (AlCl3), por exemplo.A desidrogenação do etil-benzeno é provocada pela ação do calor, na presença de óxidos metálicos, tais como óxido de zinco, cálcio, magnésio, ferro ou cobre. A temperatura do sistema deve ser entre 600ºC a 800ºC. A reação é endotérmica e a pressão é reduzida pois ela se dá com o aumento do volume.

Espero que todos tenham gostado do post de hoje e espero vocês na semana que vem para mais uma matéria legal. Até mais...
REFERÊNCIAS
MATEUS, Alfredo Luís. Química na cabeça. 4 ed. Belo Horizonte: UFMG, 2008.
http://pt.wikipedia.orgAcesso em: 01/02/2012
http://www.portalsaofrancisco.com.br/alfa/plasticos/poliestireno.phpAcesso em: 01/02/2012
loading...
- Química Orgânica - Alcenos
Alcenos Alcenos ou...
- O Que Usar? Acetona Ou Removedor?
Bolsista: Eliana Carvalho Olá queridos amigos leitores da Química da Beleza!Hoje nossa curiosidade é saber qual composto agride menos a unha quando precisamos retirar o esmalte. E para isto há...
- Ácido Acético (ch3ooh)
Bolsista: Ana Lucia Miranda Este ácido também é conhecido como etanoico, é da família dos ácidos carboxílicos, tendo dois carbonos em sua estrutura, é habitualmente encontrado na forma impura como vinagre, em soluções aquosas ele é um ácido...
- Acetonas
Bolsista Eliana A acetona usada para retirar os esmaltes é um solvente líquido incolor, inflamável, de cheiro agradável e solúvel em água e em solventes orgânicos. Ela é preparada industrialmente por...
- Alcenos - Função Hidrocarboneto
O texto abaixo foi extraído da página Química Nova Interativa: http://qnint.sbq.org.br/qni/visualizarMolecula.php?idMolecula=163 O eteno, fórmula molecular C2H4, 28.03 g.mol-1, é um gás incolor à temperatura ambiente e pressão...
