Química
A Distribuição Eletrônica Dos Elementos Químicos

Texto em construção....................
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- Distribuição Eletrônica
Bolsista: Loys Laynne Rodrigues Sousa Olá queridos, hoje vamos aprender a resolver alguns exercícios de distribuição eletrônica usando o diagrama de Linus Pauling Figura 1.Linus Carl Pauling foi um ilustríssimo químico norte ? americano, nasceu...
- Linus Pauling E A Distribuição Eletrônica
Bolsista: Leidiane Rodrigues Rosa Linus Pauling nasceu nos Estados Unidos, em 28 de fevereiro de 1901 e morreu aos 93 anos, em 20 de agosto de 1994, após uma brilhante carreira profissional, e por intensa atividade na sociedade civil. Ele foi um dos...
- Regra De Hund
Para recordar A regra de Hund foi publicada, em 1927, pelo físico alemão Friedrich Hermann Hund (1896-1997) conhecido por seu trabalho sobre a estrutura eletrônica de átomos e moléculas. Ele ajudou a introduzir o método de utilização de orbitais...
- As Cores Dos íons.
A fim de explicar por que os metais de transição "são coloridos", primeiro temos que falar um pouco sobre como os elétrons em um átomo são organizadas em torno do núcleo central. No ensino secundário, a maioria dos alunos aprende que os elétrons...
Química
A Distribuição Eletrônica
A Distribuição Eletrônica
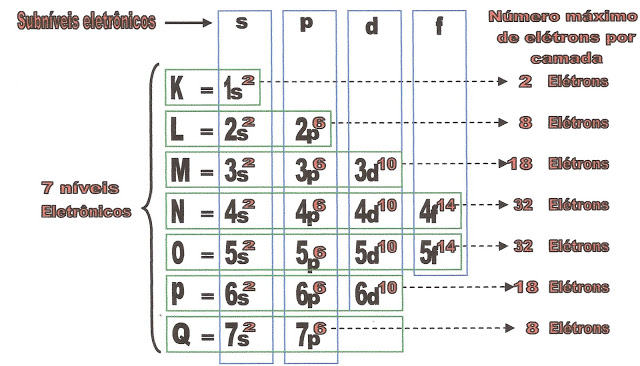
Distribuição Eletrônica em Camadas e Subcamadas
Distribuição Eletrônica em Camadas e Subcamadas
A distribuição eletrônica significa distribuir os elétrons de um átomo em camadas e subcamadas. É importante termos o conhecimento pelo fato de descobrirmos através dessa distribuição, os elétrons da camada de valência ou da subcamada que farão a ligação de um átomo com outro, para formar as moléculas ou as substâncias.
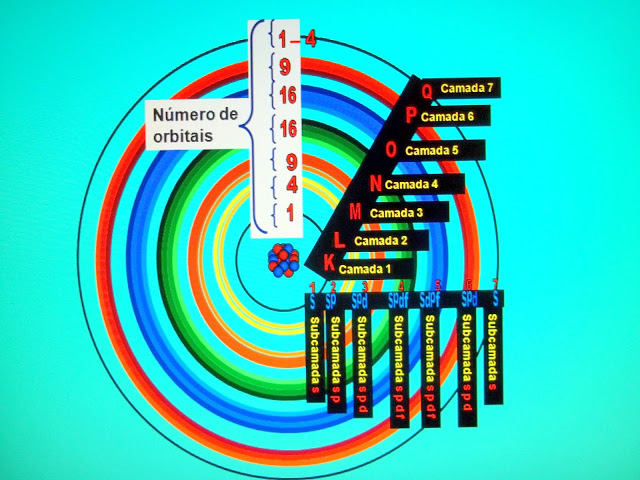
O Diagrama de Linus Pauling
O diagrama de Linus Carl Pauling, químico americano é o modelo de distribuição eletrônica para qualquer átomo da tabela periódica.
Para a distribuição dos elétrons de qualquer átomo, deve-se obedecer as regras do diagrama.
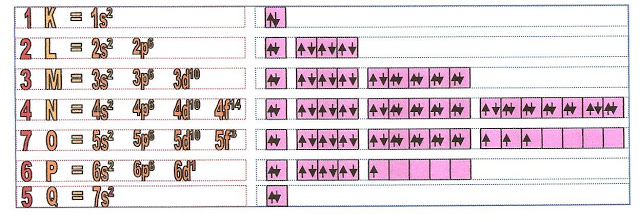
Os níveis eletrônicos são sete, K, L, M, N, O, P, Q, para os átomos naturais que são 92.
Nível 1 ou camada K, comporta no máximo 2 elétrons.
Nível 2 ou camada L, comporta no máximo 8 elétrons.
Nível 3 ou camada M, comporta no máximo 18 elétrons.
Nível 4 ou camada N, comporta no máximo 32 elétrons.
Nível 5 ou camada O, comporta no máximo 32 elétrons.
Nível 6 ou camada P, comporta no máximo 18 elétrons.
Nível 7 ou camada Q, comporta no máximo 2 ou 8 elétrons.
Os sub-níveis eletrônicos são quatro, s, p, d, f. para os átomos naturais.
O sub-nível s comporta no máximo 2 elétrons.
O sub-nível p comporta no máximo 8 elétrons.
O sub-nível d comporta no máximo 10 elétrons.
O sub-nível f comporta no máximo 14 elétrons.
Esquema da distribuição das camadas e subcamadas eletrônicas de Linus Pauling.

A representação das camadas, número de orbitais e subníveis pode ser esquematizado dessa forma:
Distribuição Eletrônica
A distribuição eletrônica é feita com o número de elétrons de cada um dos elementos químicos. O número de elétrons é o mesmo que o do número atômico de cada átomo e esse número de elétrons vai aumentando conforme a sequência dos elementos dispostos na tabela periódica.
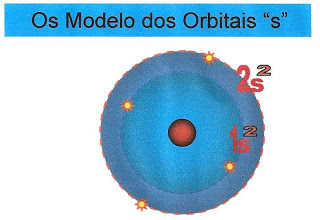
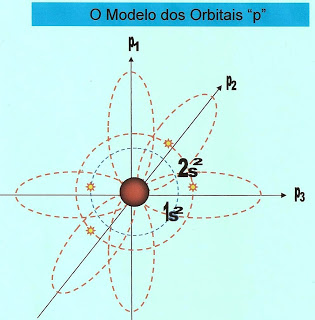
As Formas dos Orbitais dos Subníveis ?s? e ?p?
Os elétrons pertencentes ao subnível ?s? formam orbitais esféricos.
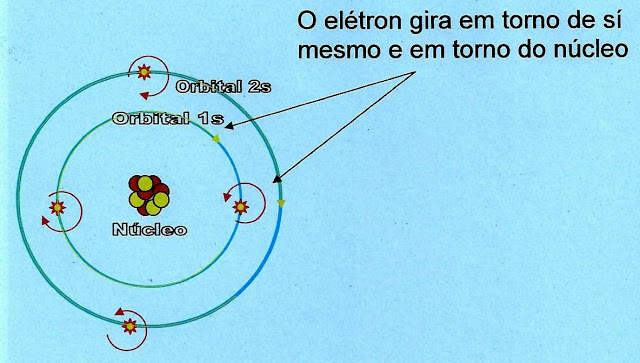
Segundo Rutherford-Bohr os elétrons se dispõem em torno do núcleo do átomo em orbitais circulares. Cada orbital comporta no máximo 2 elétrons. Os orbitais ?s? tem a forma circular enquanto que os orbitais híbridos ?p? tem a forma bilobulado ou em hélice e foi idealizado por Linus Carl Pauling.


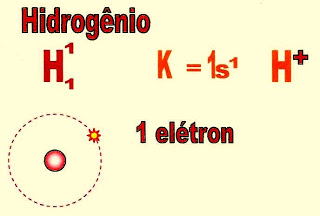
Hidrogênio (H)
O átomo de hidrogênio só possui um elétron, portanto, a sua distribuição fica contida na primeira camada, no orbital esférico (ou circular) do subnível ?s?.
O átomo de hidrogênio só possui um elétron, portanto, a sua distribuição fica contida na primeira camada, no orbital esférico (ou circular) do subnível ?s?.

Hélio (He)
O átomo de hélio possui um orbital e dois elétrons e a sua distribuição eletrônica está localizada na primeira camada K, no orbital esférico (ou circular) do subnível ?s?.

O elemento químico hélio forma o gás hélio. O gás hélio é um gás que pertence ao conjunto dos gases nobres. Esse gás é formado por um único átomo isolado, não há ligações entre os átomos de hélio para a formação desse gás, por isso é chamado de monoatômico. O gás hélio em si é uma substância simples, também não se combina com átomos ou elementos químicos diferentes.
Na condição de elemento químico, a representação estrutural de sua massa é formada por dois prótons (carga positiva) e dois nêutrons (sem carga elétrica), e possui também dois elétrons girando no orbital distante do núcleo, que balanceiam a carga positiva dos prótons. No entanto a massa dos dois elétrons não é considerada, por ser proporcionalmente desprezível.
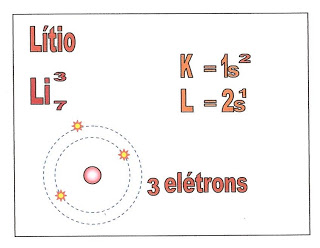
Lítio (Li)
O átomo de lítio possui três elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos ou circulares do subnível ?1s? e ?2s?.
O átomo de lítio possui três elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos ou circulares do subnível ?1s? e ?2s?.

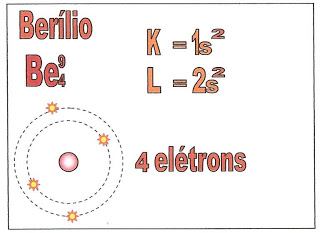
O átomo de berílio possui quatro elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos do subnível ?1s? e ?2s?.

As Formas dos Subníveis s e p
O átomo de boro possui cinco elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos no subnível ?1s? e ?2s? e um elétron no orbital p1 do subnível ?p?.
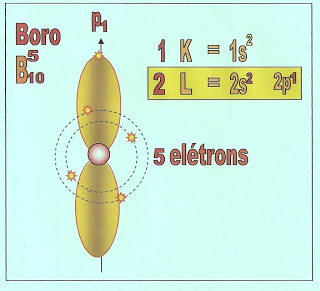 |
| Observe que no orbital "p" puro, o elétron passa atrás e na frente do núcleo relativamente equidistante como nas extremidades da hélice simbólica . |
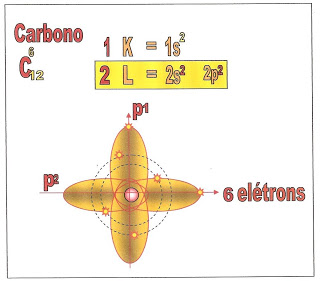
O átomo de carbono possui seis elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos no subnível ?1s? e ?2s? e dois elétrons nos orbitais p1 e p2 do subnível ?p?.

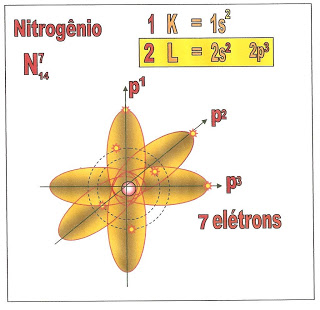
O átomo de nitrogênio possui sete elétrons, a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos com dois elétrons cada, no sub-nível ?1s? e ?2s? e três elétrons distribuidos nos orbitais p1, p2 e p3 do sub-nível ?p?.

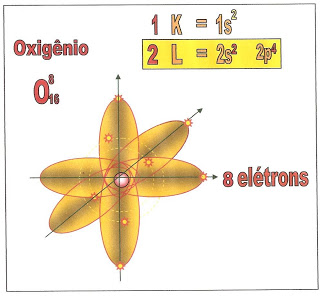
O átomo de oxigênio possui oito elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos com dois elétrons cada, no sub-nível ?1s? e ?2s? e quatro elétrons distribuidos nos orbitais p1, p2 e p3 no sub-nível ?p?. O orbital p1 possui dois elétrons e está completo e os p2 e p3 estão incompletos.

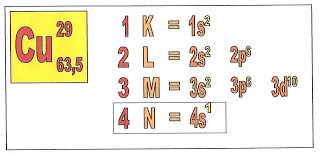
A distribuição eletrônica do átomo de cobre que possui o número atômico 29 e o mesmo número de elétrons, tem portanto, todos os níveis eletrônicos preenchidos com exceção do nível 4 subnível 1, que tem apenas um elétron.

A distribuição dos elétrons do átomo de cobre fica assim:
1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s1.
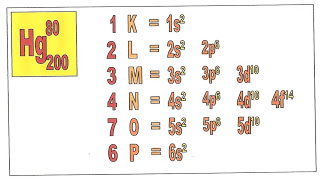
A distribuição eletrônica do átomo de mercúrio que possui o número atômico 80 e o mesmo número de elétrons, tem portanto, todos os níveis eletrônicos preenchidos.

A distribuição dos elétrons do átomo de mercúrio ficaria assim:
1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
A distribuição Eletrônica dos Elementos Químicos de Transição.
A distribuição eletrônica dos elementos de transição segue a sequência de quatro períodos e dez colunas, que toma a seguinte configuração representada na tabela a seguir.
3d1 4s2 | 3d2 4s2 | 3d3 4s2 | 3d4 4s2 | 3d5 4s2 | 3d6 4s2 | 3d7 4s2 | 3d8 4s2 | 3d9 4s2 | 3d10 4s2 |
4d1 5s2 | 4d2 5s2 | 4d3 5s2 | 4d4 5s2 | 4d5 5s2 | 4d6 5s2 | 4d7 5s2 | 4d8 5s2 | 4d9 5s2 | 4d10 5s2 |
5d2 6s2 | 5d3 6s2 | 5d4 6s2 | 5d5 6s2 | 5d6 6s2 | 5d7 6s2 | 5d8 6s2 | 5d9 6s2 | 5d10 6s2 | |
6d2 7s2 | 6d3 7s2 | 6d4 7s2 | 6d5 7s2 | 6d6 7s2 | 6d7 7s2 | 6d8 7s2 | 6d9 7s2 | 6d10 7s2 |
Vejamos exemplos: o escândio é o primeiro dos elementos de transição e a sua distribuição eletrônica fica da seguinte maneira:
21Sc45 1s2
2s2 2p6
3s2 3p6 3d1
4s2
A seguir ao escândio, vem o titânio cuja distribuição eletrônica pode ser representada:
22Ti47,9 1s2
2s2 2p6
3s2 3p6 3d2
4s2
A Abstração
Talvez no momento pensemos que filosofar é estar à margem do concreto imediatista. No entanto, ainda convém acreditar que há hipóteses e teorias que por mais que pareçam abstratas ou lúdicas, nos levam á novas buscas e procura pela verdade e nos abrem portas para novas idéias e descobertas. Se levarmos em conta a conversa entre Linus Pauling e a resposta á Heisenberg acerca da teoria apoiada em experiências, sobre as órbitas dos elétrons e de seus saltos longos, ou do tipo de salto, disse Pauling, que teria reservas em admitir tais afirmações, porém refletindo: qual das alternativas ele deveria escolher?
A Regra de Hund
Os subníveis eletrônicos só existem na teoria, as camadas eletrônicas na verdade não necessitam desses subníveis, para a distribuição de seus elétrons em orbitais ao redor do núcleo. No entanto para se ter uma explicação racional sobre o comportamento dos orbitais e seus elétrons, é que se leva em consideração uma regra que se pareça mais plausível até que se confirme essa idéia ou se prove o contrário.
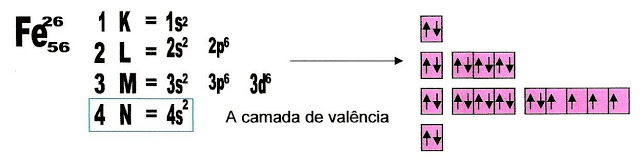
A Regra de Friedrich Hermann Hund físico alemão, diz que na distribuição eletrônica devemos preencher primeiramente todos os orbitais de um sub-nível com apenas um elétron, para depois em seguida preencher os mesmos orbitais com um segundo elétron.
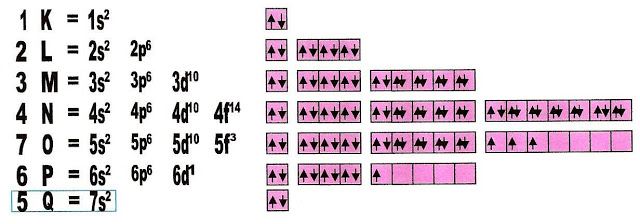
No entanto seguindo essa regra percebemos que há sub-níveis que permanecem incompletos, como no caso da distribuição eletrônica do urânio, que no subnível ?f? da quinta camada ele tem apenas três elétrons para três orbitais, os outros orbitais desse sub-nível permanecem vazios ou inexistentes. No nível seis, o subnível ?d? possui apenas um elétron permanecendo os outros vazios ou inexistentes.

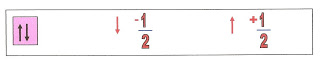
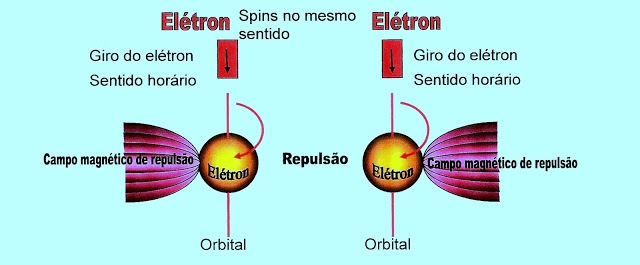
No esquema abaixo representamos simbolicamente um orbital com seus dois elétrons e o giro de cada um deles em torno de si mesmo.

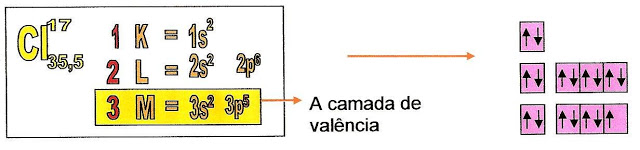
Observe o esquema abaixo da distribuição eletrônica do átomo de cloro no estado fundamental, nota-se que no subnível "p" uma "casinha" não está completamente preenchida com o número total de elétrons, pois o cloro possui na sua camada de valência sete elétrons. Cada elétron no orbital é representado por seu spin positivo ou negativo.

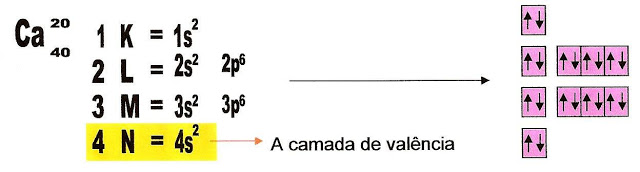
A distribuição eletrônica do átomo de cálcio no estado fundamental, ou seja; o isótopo de cálcio estável de massa 40 e número atômico 20.

A distribuição eletrônica do átomo de ferro no estado fundamental. Nota-se que que o subnível "d" do terceiro nível, os seus cinco orbitais comportam dez elétrons no entanto está preenchido com apenas 6 elétrons porque dois elétrons passam a formar a camada de valência no nível quatro.

A distribuição eletrônica do átomo de urânio no estado fundamental.

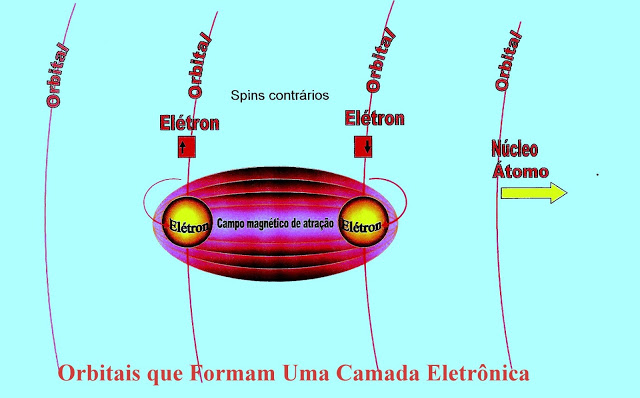
Orbitais - Elétrons e Campos Magnéticos
Os elétrons de orbitais diferentes ao girarem em suas órbitas e em torno de sí mesmos, formam campos magnéticos de atração ou de repulsão. Segundo teorias, esses campos magnéticos de atração ou de repulsão é que manteriam a conformação da estrutura atômica e esses mesmos elétrons ?presos? orbitando o átomo sem deixar seu ?caminho? e sem se aproximarem demais um dos outros.

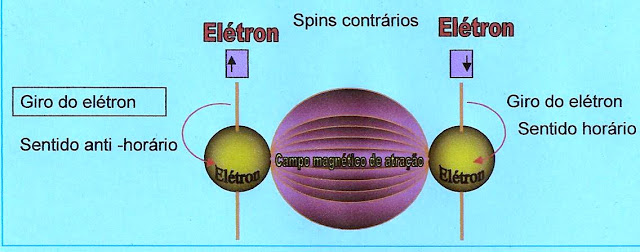
O giro dos elétrons de spins contrários formam campo magnético de atração mantendo os dois orbitais unidos.

O giro dos Elétrons de spins de sentidos contrários cria um campo de atração entre os orbitais do mesmo átomo mantendo-os unidos.
Teoricamente, os campos magnéticos de atração, formados pelos elétrons girando nos seus respectivos orbitais, formariam as camadas eletrônicas e manteriam os orbitais unidos nessas camadas que são atraídas pelo núcleo do átomo.

O giro dos elétrons de spins no mesmo sentido cria o campo magnético de repulsão dos orbitais.

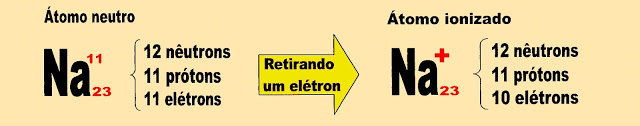
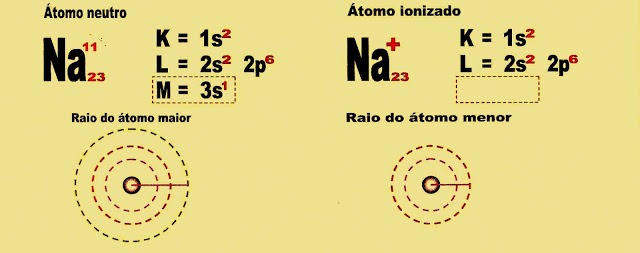
A Distribuição Eletrônica de um Íon
Quando um átomo está no estado neutro, as suas cargas de prótons e elétrons estão equilibradas. Então, por exemplo; se um átomo tem seis prótons e também tem seis elétrons, as cargas positivas e negativas estão em equilíbrio, nesse caso ele é um átomo que está no estado neutro. Se o átomo perdeu ou ganhou elétrons, o número entre seus prótons e elétrons está em desequilíbrio, portanto esse átomo está no estado ionizado. Os íons podem ser chamados de cátions quando o número de prótons do seu núcleo superar o de elétrons que giram nos seus orbitais distantes do núcleo, e podem ser chamados de ânions quando o número de elétrons superar o de prótons.
Distribuição Eletrônica do Átomo de Sódio
Distribuição Eletrônica do Átomo de Sódio


Texto em construção....................
loading...
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- Distribuição Eletrônica
Bolsista: Loys Laynne Rodrigues Sousa Olá queridos, hoje vamos aprender a resolver alguns exercícios de distribuição eletrônica usando o diagrama de Linus Pauling Figura 1.Linus Carl Pauling foi um ilustríssimo químico norte ? americano, nasceu...
- Linus Pauling E A Distribuição Eletrônica
Bolsista: Leidiane Rodrigues Rosa Linus Pauling nasceu nos Estados Unidos, em 28 de fevereiro de 1901 e morreu aos 93 anos, em 20 de agosto de 1994, após uma brilhante carreira profissional, e por intensa atividade na sociedade civil. Ele foi um dos...
- Regra De Hund
Para recordar A regra de Hund foi publicada, em 1927, pelo físico alemão Friedrich Hermann Hund (1896-1997) conhecido por seu trabalho sobre a estrutura eletrônica de átomos e moléculas. Ele ajudou a introduzir o método de utilização de orbitais...
- As Cores Dos íons.
A fim de explicar por que os metais de transição "são coloridos", primeiro temos que falar um pouco sobre como os elétrons em um átomo são organizadas em torno do núcleo central. No ensino secundário, a maioria dos alunos aprende que os elétrons...
