Química
 Ligação Covalente Molecular Normal - A Formação de Substâncias Simples
Ligação Covalente Molecular Normal - A Formação de Substâncias Simples
Representação Esquemática

Estrelinha - representa um elétron.
Par de estrelinhas - representa o par de elétrons compartilhado.
Traço - representa a ligação covalente molecular normal.
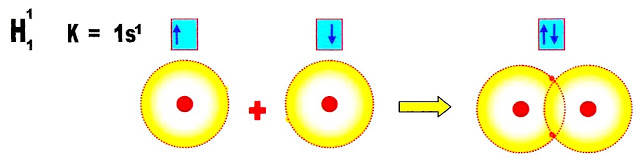
A formação do gás hidrogênio
 Hidrogênio ligação covalente molecular
Hidrogênio ligação covalente molecular
O gás hidrogênio é um combustível muito potente não poluente, a sua combustão seja em veículos automotores, ou em outra forma de produção de energia, não liberará substâncias nocivas à saúde humana.
A formação do gás flúor

- Ligação Iônica
A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron....
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Tipos De Ligações
Bolsista: Litton jrOlá seguidores do QUIPIBID! Essa semana estaremos falando de ligações Iônicas e covalentes. Introdução Os átomos ligam-se para adquirir maior estabilidade.Gases nobres: únicos elementos que aparecem na natureza na forma de átomos...
- Regra De Hund
Para recordar A regra de Hund foi publicada, em 1927, pelo físico alemão Friedrich Hermann Hund (1896-1997) conhecido por seu trabalho sobre a estrutura eletrônica de átomos e moléculas. Ele ajudou a introduzir o método de utilização de orbitais...
- Números Quânticos ? Teoria E Exercícios Resolvidos.
O aluno deve estar atento a alguns pontos: sabendo da complexidade das teorias e modelos atômicos e levando em consideração o modelo atômico atual, é importante lembrar que em qualquer átomo, cada estrutura elétrica chamada de elétron,...
Química
Ligação Covalente Molecular Normal
Ligações Covalentes
As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos e não metálicos. É o tipo de ligação em que o par de elétrons é compartilhado por dois átomos. Esse par de elétrons, ou pares de elétrons, é (são) formado (s) por elétrons de cada um dos átomos participantes.
As Formas Dos Orbitais e as Ligações ?s? e ?p?.
As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos e não metálicos. É o tipo de ligação em que o par de elétrons é compartilhado por dois átomos. Esse par de elétrons, ou pares de elétrons, é (são) formado (s) por elétrons de cada um dos átomos participantes.
As Formas Dos Orbitais e as Ligações ?s? e ?p?.
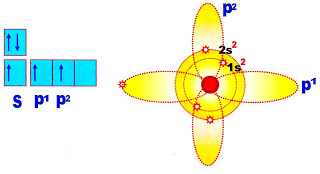
A Forma do Orbital "s"
Todos os orbitais do sub-nível ?s? possuem a forma circular.
A substância simples formada por hidrogênios o gás hidrogênio, conforme a distribuição eletrônica, só possui o orbital ?s?, a ligação formada é do tipo sigma (?) ou s - s.

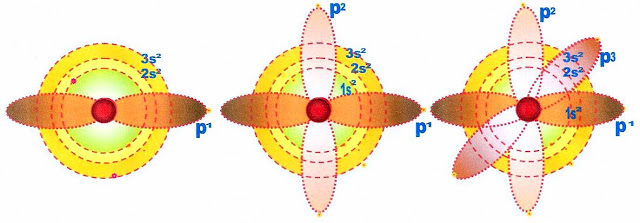
As Formas Dos Orbitais ?p?. P1, p2, p3
O orbital p é alongado em forma de hélice ou bilobulado direcionado para um um eixo central, o núcleo do átomo.
A figura abaixo representa os orbitais do subnível 1S, 2S, e 3S e o subnível p com os orbitais p1, p2 e p3.
O orbital p é alongado em forma de hélice ou bilobulado direcionado para um um eixo central, o núcleo do átomo.
A figura abaixo representa os orbitais do subnível 1S, 2S, e 3S e o subnível p com os orbitais p1, p2 e p3.

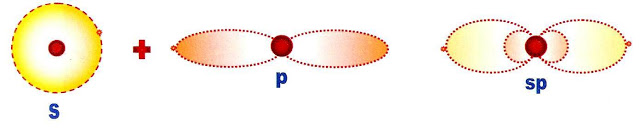
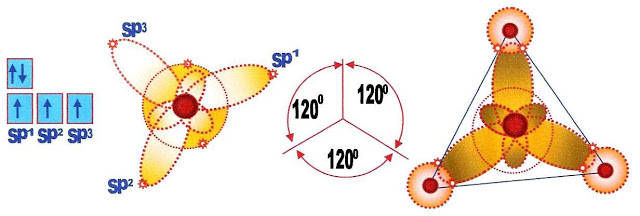
A Hibridação s e p Dos Orbitais
Hibridação pode ser definida como a rearrumação dos níveis de energia ou dos orbitais, de um átomo para que ele possa se unir a outro átomo. Os orbitais s e p puros podem sofrer "fusão" e se transformarem em orbital (is) sp.
O orbital s que é circular se alonga e o orbital p que é longo encurta, tomando a aparência sugerida na figura abaixo.
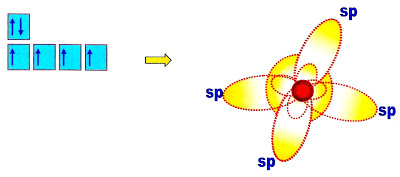
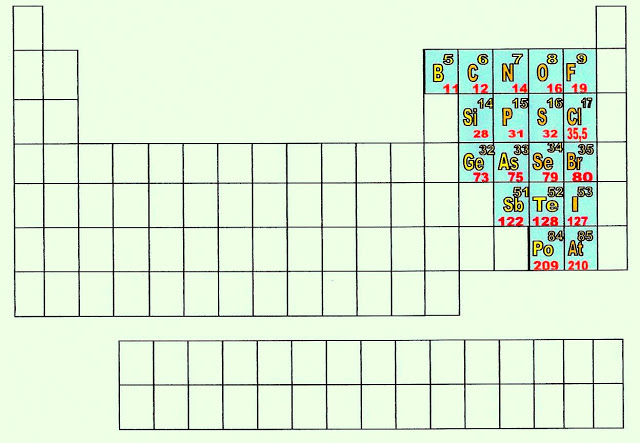
Os Elementos Químicos da Tabela Periódica Que Formam as Ligações Covalentes Moleculares NormaisHibridação pode ser definida como a rearrumação dos níveis de energia ou dos orbitais, de um átomo para que ele possa se unir a outro átomo. Os orbitais s e p puros podem sofrer "fusão" e se transformarem em orbital (is) sp.
O orbital s que é circular se alonga e o orbital p que é longo encurta, tomando a aparência sugerida na figura abaixo.

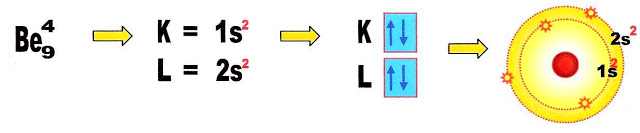
A Hibridação do Berílio
A hibridação do berílio para a ligação com o hidrogênio (aqui o berílio não está presente na relação da tabela periódica apresentada mais abaixo, como átomo que faz parte nas ligações covalentes moleculares).
Primeiramente fazermos a distribuição eletrônica para sabermos como os seus elétrons estão posicionados nos orbitais.

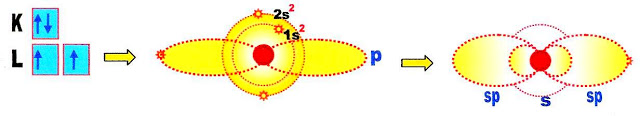
Observando a distribuição eletrônica do átomo de berílio percebemos que os elétrons estão parelhados em seus orbitais preenchendo-os totalmente. Nesse caso não há como o berílio se ligar a outro átomo para formar outra substância sem que haja mudança estrutural, é necessário haver transformações na sua estrutura atômica para que possa formar novos orbitais e se ligar a outro átomo. Portanto ocorre a hibridação ou seja a formação de novos orbitais.

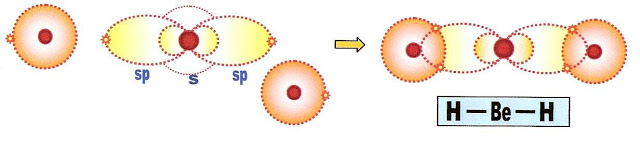
Finalmente os hidrogênios se aproximam e se ligam ao berílio.

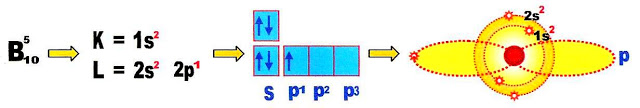
Hibridação do Boro
Vejamos o passo a passo da hibridação.
O elemento químico boro no estado fundamental se apresenta conforme o esquema:

Inicialmente o boro passa por um processo de ativação. Ao ser ativado ocorre o deslocamento de um elétron do subnivel s para o subnivel p, portanto, esse nível passa a ter dois orbitais p, o p1 e o p2.

Ao ser hibridizado a molécula do boro passa a ter a configuração com orbitais sp da seguinte forma: O orbital 2s se alonga e forma o sp, os dois orbitais p formados ?encolhem? sua órbita e se transformam em sp. Desse modo a estrutura formada passa a ter três orbitais sp. Sp1 sp2 e sp3 semi preenchidos com apenas um elétron cada e um orbital s completamente preenchido com 2 elétrons conforme mostra o esquema:

Convém também salientar a disposição geométrica de cada um dos orbitais híbridos da molécula formada possui ângulos de 120 graus.
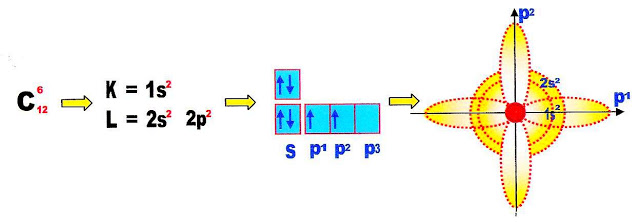
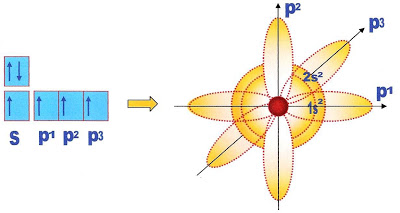
A Hibridação Sp3 do Carbono
O átomo de carbono pode se hibridizar formando o tipo de hibridação sp3. Vejamos passo a passo essa configuração atômica.

A última camada do átomo de carbono possui 4 elétrons distribuidos em dois subníveis o s preenchido e o p, este último semi preenchido com um elétron cada e um orbital completamente vazio. Um elétron do orbital ou subnível s passa para o orbital ou subnível p formando o orbital p3 semi preenchido.

Finalmente ocorre a transformação do orbital s que ficou semi-preenchido com apenas um elétron que sendo circular se alonga se transformando em sp. Os três orbitais p, longos semi-preenchidos com um elétron cada se retraem adquirindo a conformação sp. Ao todo são formados 4 orbitais sp com um elétron cada.

Quando as ligações covalentes forem do tipo simples ou sigma.
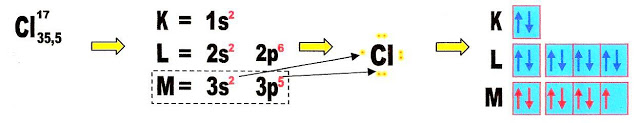
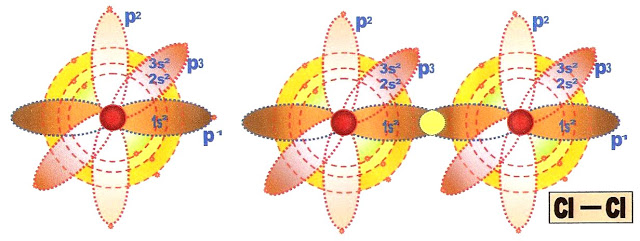
Podemos observar esse acontecimento através da distribuição eletrônica do elemento químico cloro, na formação da molécula do gás cloro em que na última camada, ou no último orbital cada átomo possui apenas um elétron. Nesse caso acontece a junção desse orbital semi preenchido com o orbital do outro átomo, também semi preenchido, que formará a ligação sigma pura p, p na molécula. Nesse caso não há a necessidade de hibridização do (s) orbital (is).



Representação Esquemática

Estrelinha - representa um elétron.
Par de estrelinhas - representa o par de elétrons compartilhado.
Traço - representa a ligação covalente molecular normal.
A formação do gás hidrogênio

O gás hidrogênio é um combustível muito potente não poluente, a sua combustão seja em veículos automotores, ou em outra forma de produção de energia, não liberará substâncias nocivas à saúde humana.
A formação do gás flúor

Flúor ligação covalente molecular
A formação do gás cloro
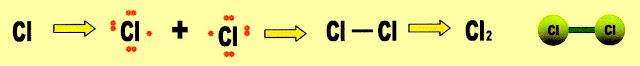 Cloro ligação covalente molecular normal
Cloro ligação covalente molecular normal
A formação da substância bromo
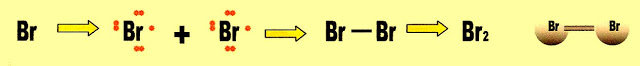 Bromo ligação covalente molecular normal
Bromo ligação covalente molecular normal
A formação da substância iodo
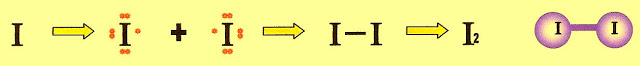 Iodo ligação covalente molecular normal
Iodo ligação covalente molecular normal
A formação da substância gás oxigênio
 Oxigênio ligação covalente molecular normal dupla
Oxigênio ligação covalente molecular normal dupla
A formação da substância gás nitrogênio
 Nitrogênio ligação covalente molecular normal tripla
Nitrogênio ligação covalente molecular normal tripla
Química - Eduardo Fleury Mortimer, Andrea Horta Machado. Editora Scipione, 2011. Volume 1, p. 248 a 265.
Química - Antônio Sardella. Editora Ática, 2005. Volume único, p. 54 a 66.
Química o Homem e a Natureza - José Geraldo Couvre. Editora Moderna, 2000. Volume 1, p. 166 a 199.
Química na Abordagem do Cotidiano - Francisco Miragaia Peruzzo, Eduardo Leite Canto. Editora Moderna, 2008. Volume 1, p. 115 a 127.
A formação do gás cloro

A formação da substância bromo

A formação da substância iodo
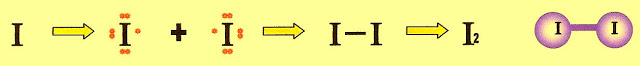
A formação da substância gás oxigênio

A formação da substância gás nitrogênio

Formação de Substâncias Compostas Com Ligação Covalente Molecular Simples

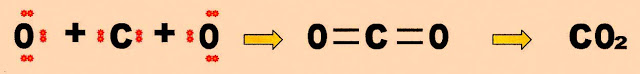


Química - química geral - Ricardo Feltre. Editora Moderna, 2007. Volume 1, p.136 a 155.
Completamente Química - Química Geral - Martha Reis. Editora FTD, 2001. Volume 1, p. 411 a 446.A formação do ácido clorídrico

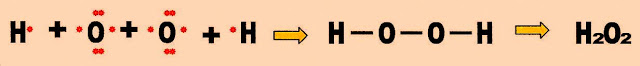
A formação da água oxigenada

A formação da molécula de gás carbônico. Essa molécula é apolar, portanto as ligações intermoleculares entre as moléculas do gás carbônico é do tipo dipolo instantâneo-dipolo induzido.
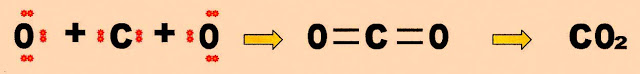
A formação da molécula do trióxido de dinitrogênio

A formação da molécula de água

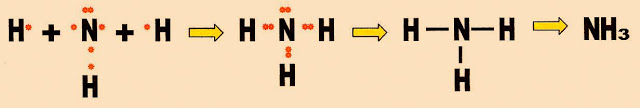
A formação da molécula de amônia

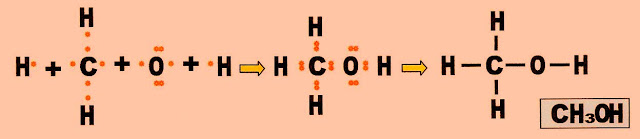
A formação da molécula do metanol

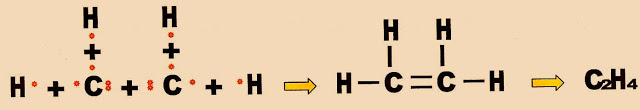
A formação da molécula do gás eteno ou etileno

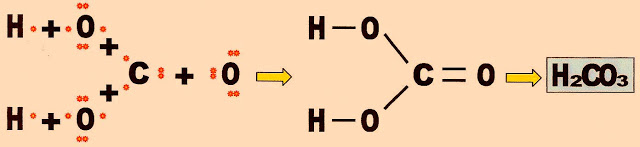
A formação da molécula do ácido carbônico

Bibliografia
Química - Eduardo Fleury Mortimer, Andrea Horta Machado. Editora Scipione, 2011. Volume 1, p. 248 a 265.
Química - Antônio Sardella. Editora Ática, 2005. Volume único, p. 54 a 66.
Química o Homem e a Natureza - José Geraldo Couvre. Editora Moderna, 2000. Volume 1, p. 166 a 199.
Química na Abordagem do Cotidiano - Francisco Miragaia Peruzzo, Eduardo Leite Canto. Editora Moderna, 2008. Volume 1, p. 115 a 127.
loading...
- Ligação Iônica
A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron....
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Tipos De Ligações
Bolsista: Litton jrOlá seguidores do QUIPIBID! Essa semana estaremos falando de ligações Iônicas e covalentes. Introdução Os átomos ligam-se para adquirir maior estabilidade.Gases nobres: únicos elementos que aparecem na natureza na forma de átomos...
- Regra De Hund
Para recordar A regra de Hund foi publicada, em 1927, pelo físico alemão Friedrich Hermann Hund (1896-1997) conhecido por seu trabalho sobre a estrutura eletrônica de átomos e moléculas. Ele ajudou a introduzir o método de utilização de orbitais...
- Números Quânticos ? Teoria E Exercícios Resolvidos.
O aluno deve estar atento a alguns pontos: sabendo da complexidade das teorias e modelos atômicos e levando em consideração o modelo atômico atual, é importante lembrar que em qualquer átomo, cada estrutura elétrica chamada de elétron,...
