Química
Há tempos alguém que nos lê disse-nos o seguinte:
achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada.
Vamos pois então falar um pouco mais de ligações de hidrogénio. Mas não hoje? tem mesmo que ficar para amanhã! Antes disso temos que introduzir um conceito muito importante. O conceito de electronegatividade.
Como já aqui temos dito, todas as substâncias são formadas de pequenas partículas chamadas átomos. Cada átomo é constituído por um núcleo, contendo partículas electronicamente neutras, os neutrões, e contendo protões que têm carga positiva.
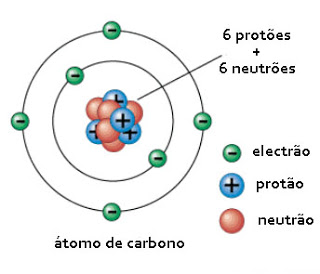
Em volta do núcleo existem electrões, carregados negativamente, em igual número ao de protões, de modo a que a carga total seja zero. Tal como aqui está representado, de uma forma muito simplificada, para o átomo de carbono.
A electronegatividade mede o poder dos átomos de atrair os seus electrões. Ou, fazendo um paralelismo com outras situações, há átomos que ?gostam muito? dos seus electrões e não gostam que eles ?vão à vida deles?, de preferência até querem mais e puxam os dos vizinhos para junto deles, e há outros que são um pouco menos "possessivos".

 Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
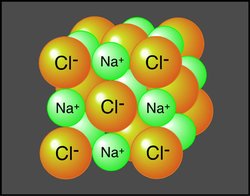
Se há uma diferença muito grande de electronegatividades formam-se ligações iónicas, como acontece no sal de cozinha. De facto se há uma diferença suficiente de electronegatividades um dos átomos perde completamente um electrão e forma um catião (fica com uma carga positiva) e o outro átomo recebe esse electrão e forma o anião (fica com uma carga negativa). O catião e o anião, tendo cargas opostas atraiem-se e forma-se uma ligação iónica.
Os átomos que ficam no meio da escala de electronegatividade, não têm tendência a perder ou ganhar electrões, não formam iões e portanto formam ligações covalentes, em que partilham electrões. O mesmo acontece entre átomos que podem estar nos extremos da tabela de electronegatividade, mas têm electronegatividades idênticas. Exemplos de ligações covalentes são o hidrogénio H-H ou a água H-O-H. E as pontes de enxofre, ligação -S-S- de que falámos aqui.
No caso do hidrogénio, o par de electrões é partilhado por dois átomos idênticos os electrões são igualmente partilhados pelos dois átomos.
 Contudo se os dois átomos que participam na ligação covalente têm diferentes electronegatividades, ou estão ligados a átomos com diferentes electronegatividades, a partilha é desigual. Isto significa que os electrões estão mais deslocados para o lado do átomo mais electronegativo, ou por outras palavras a ligação está polarizada. É o caso por exemplo de uma ligação C-O ou O-H.
Contudo se os dois átomos que participam na ligação covalente têm diferentes electronegatividades, ou estão ligados a átomos com diferentes electronegatividades, a partilha é desigual. Isto significa que os electrões estão mais deslocados para o lado do átomo mais electronegativo, ou por outras palavras a ligação está polarizada. É o caso por exemplo de uma ligação C-O ou O-H.
 Tudo isto está na base dos comportamentos diferentes das substâncias e na forma como vão interagir entre si. Vai também ser muito útil para compreender o que são e como se formam as ligações de hidrogénio.
Tudo isto está na base dos comportamentos diferentes das substâncias e na forma como vão interagir entre si. Vai também ser muito útil para compreender o que são e como se formam as ligações de hidrogénio.
(as animações acima foram retiradas DAQUI)
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- Ligações Iónicas E Ligações Covalentes
Nós sabemos que está de férias... mas as férias são uma boa altura para aprender mais... Em posts anteriores já lhe falámos de ligações químicas, de ligações iónicas e covalentes... Mas afinal o que é isso? As ligações químicas são uniões...
- Gorduras Saturadas, óleos Poli-insaturados... Afinal O Que é Isso?
Já ouviu certamente falar de gorduras saturadas, de óleos poli-nsaturados... mas se calhar não sabe bem o que é isso. É também , na generalidade dos casos, o grau de insaturação de um trglicérido que vai determnar se é uma gordura ou um óleo....
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Tipos De Ligações
Bolsista: Litton jrOlá seguidores do QUIPIBID! Essa semana estaremos falando de ligações Iônicas e covalentes. Introdução Os átomos ligam-se para adquirir maior estabilidade.Gases nobres: únicos elementos que aparecem na natureza na forma de átomos...
Química
A electronegatividade dos elementos explica muita coisa...
Há tempos alguém que nos lê disse-nos o seguinte:
achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada.
Vamos pois então falar um pouco mais de ligações de hidrogénio. Mas não hoje? tem mesmo que ficar para amanhã! Antes disso temos que introduzir um conceito muito importante. O conceito de electronegatividade.
Como já aqui temos dito, todas as substâncias são formadas de pequenas partículas chamadas átomos. Cada átomo é constituído por um núcleo, contendo partículas electronicamente neutras, os neutrões, e contendo protões que têm carga positiva.

Em volta do núcleo existem electrões, carregados negativamente, em igual número ao de protões, de modo a que a carga total seja zero. Tal como aqui está representado, de uma forma muito simplificada, para o átomo de carbono.
A electronegatividade mede o poder dos átomos de atrair os seus electrões. Ou, fazendo um paralelismo com outras situações, há átomos que ?gostam muito? dos seus electrões e não gostam que eles ?vão à vida deles?, de preferência até querem mais e puxam os dos vizinhos para junto deles, e há outros que são um pouco menos "possessivos".

 Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos. Se há uma diferença muito grande de electronegatividades formam-se ligações iónicas, como acontece no sal de cozinha. De facto se há uma diferença suficiente de electronegatividades um dos átomos perde completamente um electrão e forma um catião (fica com uma carga positiva) e o outro átomo recebe esse electrão e forma o anião (fica com uma carga negativa). O catião e o anião, tendo cargas opostas atraiem-se e forma-se uma ligação iónica.

Os átomos que ficam no meio da escala de electronegatividade, não têm tendência a perder ou ganhar electrões, não formam iões e portanto formam ligações covalentes, em que partilham electrões. O mesmo acontece entre átomos que podem estar nos extremos da tabela de electronegatividade, mas têm electronegatividades idênticas. Exemplos de ligações covalentes são o hidrogénio H-H ou a água H-O-H. E as pontes de enxofre, ligação -S-S- de que falámos aqui.
No caso do hidrogénio, o par de electrões é partilhado por dois átomos idênticos os electrões são igualmente partilhados pelos dois átomos.


(as animações acima foram retiradas DAQUI)
loading...
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- Ligações Iónicas E Ligações Covalentes
Nós sabemos que está de férias... mas as férias são uma boa altura para aprender mais... Em posts anteriores já lhe falámos de ligações químicas, de ligações iónicas e covalentes... Mas afinal o que é isso? As ligações químicas são uniões...
- Gorduras Saturadas, óleos Poli-insaturados... Afinal O Que é Isso?
Já ouviu certamente falar de gorduras saturadas, de óleos poli-nsaturados... mas se calhar não sabe bem o que é isso. É também , na generalidade dos casos, o grau de insaturação de um trglicérido que vai determnar se é uma gordura ou um óleo....
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Tipos De Ligações
Bolsista: Litton jrOlá seguidores do QUIPIBID! Essa semana estaremos falando de ligações Iônicas e covalentes. Introdução Os átomos ligam-se para adquirir maior estabilidade.Gases nobres: únicos elementos que aparecem na natureza na forma de átomos...
