Química
- E Como Ferve?
4. Os 100oC da fervura ... Quando toda a água está no estado líquido, o calor fornecido faz com que a sua temperatura suba, até se atingirem os 100oC. Aqui, de novo, vai-se atingir um patamar como o que é mostrado no gráfico do post anterior,...
- Um Comportamento Pouco Normal!
3. O gelo e o seu estranho comportamento Observando o gráfico, pode ver-se que se tivermos água a uma temperatura inferior a 0oC, ela se encontra no estado sólido (gelo). Se lhe fornecermos calor (energia), a sua temperatura vai aumentando, até se...
- Voltando à Representação De Moléculas...
O que é a Química? Química é a ciência que se ocupa das moléculas. E o que são moléculas? São associações estáveis de 2 ou mais átomos. São exemplos de moléculas o oxigénio gasoso (O2), a água (H2O), o dióxido de carbono (CO2)...
- Ligações Intermoleculares
Ligações Intermoleculares Os átomos dos gases nobres não se ligam para formarem suas substâncias. O gás argônio que produz a luz azul esverdeada é um exemplo de uma substância formada...
- Água, Todas As Chances De Passar Despercebida.
Bolsista:Darlyane Ribeiro Olá caros leitores!Água, incolor, inodora, insípida, teria tudo para ser simplesmente mais uma substância, mas pelo contrário, particularmente uma das mais importantes, de todo planeta....
Química
Água
 |
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/ |
Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.
A molécula de água (H2O) é simples e pequena, constituída apenas por dois átomos de hidrogénio (H) e um de oxigénio (O). E apesar desta simplicidade, as diferentes características dos átomos de hidrogénio e oxigénio conferem-lhe uma estrutura e propriedades essenciais à Vida (tal como a conhecemos), sendo o principal constituinte das células.
Devido ao número de electrões que cada átomo isolado de hidrogénio e oxigénio têm, as ligações entre o átomo de oxigénio, central, e os átomos de hidrogénio, nas extremidades, apresentam uma estrutura angular (ângulo de 104,5o) (Figura 1). As ligações oxigénio-hidrogénio estão polarizadas, criando uma diferença de cargas na molécula: uma zona com carga negativa (zona superior na Figura 1) e outra com carga positiva (zona inferior na Figura 1), dando origem a um dipolo. Esta polarização, a maior densidade de electrões no átomo de oxigénio e a estrutura angular, tornam a molécula de água uma molécula polar.
Devido ao número de electrões que cada átomo isolado de hidrogénio e oxigénio têm, as ligações entre o átomo de oxigénio, central, e os átomos de hidrogénio, nas extremidades, apresentam uma estrutura angular
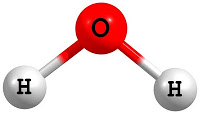 |
| Figura 1. Molécula de água |
A polaridade da molécula da água é essencial para dissolver as pequenas moléculas polares e os compostos com carga, os iões, permitindo que sejam levados (por exemplo, pelo sangue ou pela seiva), até aos tecidos e às células, onde são necessários ao seu normal funcionamento.
A polaridade da molécula de água também possibilita que as moléculas de água se atraiam mutuamente, permitindo que uma molécula tão pequena e tão leve exista no estado líquido à temperatura ambiente (por exemplo, o dióxido de carbono é cerca de 2,5 vezes mais pesado e é um gás). No estado sólido apresenta outra característica muito pouco frequente nos compostos: a mesma quantidade de água ocupa mais espaço no estado sólido que no estado líquido (e, por isso, não se devem colocar recipientes cheios com água, ou outro líquido que a contenha, a congelar); esta menor densidade permite que o gelo flutue na água líquida, permitindo que a Vida continue, nos cursos de água, sob a camada de água gelada. A menor densidade ocorre devido ao arranjo mais ordenado das moléculas de água no estado sólido que no estado líquido, característica comum aos outros compostos, mas que na água origina uma estrutura com ?cavidades?, sem quaisquer moléculas no seu interior. Quando algumas moléculas de água ocupam estas cavidades, a água torna-se mais densa, atingindo a sua maior densidade a 4 oC, quando um litro de água pesa um quilograma.
A polarização das ligações na molécula da água provoca uma forte atracção entre os átomos de oxigénio de uma molécula e os átomos de hidrogénio das moléculas vizinhas. Para quebrar essa interacção, conhecida por ligação de hidrogénio, é necessário muita energia. Por isso, para evaporar água, isto é, para fazer passar as moléculas de água do estado líquido ao estado gasoso, onde estão separadas umas das outras, é preciso elevar a temperatura até aos 100 oC.
No dia-a-dia, podemos executar diversas tarefas sem que a quantidade de água perdida do nosso corpo seja significativa. E a perda de água pelo suor, durante o exercício físico ou nos períodos de febre, permite dissipar grande quantidade de energia com uma pequena quantidade de água. Isto acontece porque, para aumentar em 1 oC a temperatura de 1 quilograma de água, precisamos de consumir 1000 calorias (1 quilocaloria); o valor desta propriedade (conhecida por calor específico da água) é muito superior ao valor dos metais e ao de diversos líquidos comuns, e facilita a resistência dos seres vivos à perda de água, em situações em que a temperatura seja elevada. Para além disso, a água conduz facilmente o calor permitindo a rápida distribuição deste, contribuindo para manter constante a temperatura corporal.
Há ainda outra propriedade da água que tem grande interesse químico e biológico: a capacidade de reagir quer como ácido quer como base, e dessa forma reagir com outras bases ou outros ácidos: dizemos que a água é uma substância anfotérica. Esta propriedade resulta também da polarização da ligação entre os átomos de oxigénio e hidrogénio que permite a quebra da ligação oxigénio-hidrogénio formando-se uma espécie química com carga positiva (o catião hidrogénio ou hidrão) e uma espécie química com carga negativa, o anião hidróxido; a pH neutro, estas espécies químicas existem em quantidades iguais. Estes iões encontram-se estabilizados, em água, ao serem atraídas pelo pólo de carga oposta das outras moléculas de água. Estas espécies químicas e a facilidade com que se formam permitem que a água reaja com outros compostos ácidos ou básicos, retirando-lhes um ião hidrogénio ou cedendo-lhe o seu, respectivamente; desta forma, em água, os iões hidrogénio e o ião hidróxido são as espécies ácidas e básicas mais fortes que podem existir, diminuindo o carácter ácido ou básico de outros compostos.
A água é uma pequena e simples molécula cujas estrutura e propriedades a tornam tão especial para a Vida, mesmo que, no nosso atarefado dia-a-dia, não nos apercebamos da sua importância. Vital.
Por
António Teixeira*
* Prof. Dep. Química da ECTUE e Centro de Química de Évora (CQE)
Publicado no Jornal "Diário do Sul" em 9/2/2011
Disponível no Jornal On-Line da Universidade de Évora (UELine)
loading...
- E Como Ferve?
4. Os 100oC da fervura ... Quando toda a água está no estado líquido, o calor fornecido faz com que a sua temperatura suba, até se atingirem os 100oC. Aqui, de novo, vai-se atingir um patamar como o que é mostrado no gráfico do post anterior,...
- Um Comportamento Pouco Normal!
3. O gelo e o seu estranho comportamento Observando o gráfico, pode ver-se que se tivermos água a uma temperatura inferior a 0oC, ela se encontra no estado sólido (gelo). Se lhe fornecermos calor (energia), a sua temperatura vai aumentando, até se...
- Voltando à Representação De Moléculas...
O que é a Química? Química é a ciência que se ocupa das moléculas. E o que são moléculas? São associações estáveis de 2 ou mais átomos. São exemplos de moléculas o oxigénio gasoso (O2), a água (H2O), o dióxido de carbono (CO2)...
- Ligações Intermoleculares
Ligações Intermoleculares Os átomos dos gases nobres não se ligam para formarem suas substâncias. O gás argônio que produz a luz azul esverdeada é um exemplo de uma substância formada...
- Água, Todas As Chances De Passar Despercebida.
Bolsista:Darlyane Ribeiro Olá caros leitores!Água, incolor, inodora, insípida, teria tudo para ser simplesmente mais uma substância, mas pelo contrário, particularmente uma das mais importantes, de todo planeta....
