Química
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Átomos - Hidrogênio
Os Elementos Químicos da Tabela Periódica Os Elementos Químicos Os elementos químicos, podem ser descritos como as partículas básicas formadoras de toda a matéria que conhecemos. Os elementos químicos naturais conhecidos pelo...
- Comentários - A Produção Da Cal
Professor:...
- Questões 1a Série Caderno Do Aluno Vol.1
...
- A Matéria E Suas Transformações
A Definição de Matéria Transformações ...
Química
A Matéria
A Matéria
Início da Química
Início da Química
Conceitos Fundamentais Sobre a Matéria
Toda a matéria conhecida teria origem no Big Bang, uma grande explosão que aconteceu há bilhões de anos atrás, que criou o espaço e o tempo, também os elementos para a formação do universo. Sua energia primordial liberada seria a responsável pela conversão em subpartículas menores da matéria, os quarks que por sua vez formariam os prótons de carga positiva, formariam também os nêutrons e outro tipo de partícula ?geraria? os elétrons. A partir desse ponto entraria em ação outra força coadjuvante, o magnetismo responsável pela atração das subpartículas criadas que se juntariam na formação dos tijolos fundamentais da construção da matéria visível, gerando corpos cada vez maiores, até formarem os grandes planetas e as estrelas.
Juntamente com a matéria formada, houve a criação das propriedades específicas que mantém a sua estrutura e estabilidade como matéria. Essas propriedades são o espaço necessário para as formas e a dimensão dos corpos e o seu lugar de ocupação naquele espaço, sua densidade e peso, também seus estados físicos na qual se apresenta, nas formas de plasma, gasosa, líquida e sólida.

Juntamente com a matéria formada, houve a criação das propriedades específicas que mantém a sua estrutura e estabilidade como matéria. Essas propriedades são o espaço necessário para as formas e a dimensão dos corpos e o seu lugar de ocupação naquele espaço, sua densidade e peso, também seus estados físicos na qual se apresenta, nas formas de plasma, gasosa, líquida e sólida.
A foto ao lado mostra a atmosfera. O que dá a cor azul do céu, as nuvens, as colinas ao fundo, as árvores, as construções civis, as casas, tudo é matéria.
A matéria que conhecemos é formada por átomos que podem ser de uma única espécie, por exemplo; o gás hidrogênio puro (H2), formado por dois átomos de hidrogênios, ou ainda por ouro puro (Au) 24 quilates que pode ser transformado em uma barra de ouro, ou mesmo por átomos de diferentes espécies como a água (H2O) que é formada por dois átomos de hidrogênio e um átomo de oxigênio.
Elementos químicos
Átomos

Os elementos químicos são os átomos isolados, como por exemplo; o átomo do elemento químico hidrogênio (H), oxigênio (O), ouro (Au)...etc. O átomo isolado pode formar uma substância. o gás hélio, gás neônio que são gases nobres possuem seus átomos isolados e não formam moléculas. O ouro puro também é uma substância formada por átomos isolados, seus átomos não formam moléculas. Esse elemento químico que forma a substância ouro se liga um ao outro por ligações metálicas criando a matéria sólida ouro puro. Outros átomos de elementos químicos diferentes se ligam formado moléculas e compostos iônicos.


Moléculas
Elementos Químicos Formando Moléculas
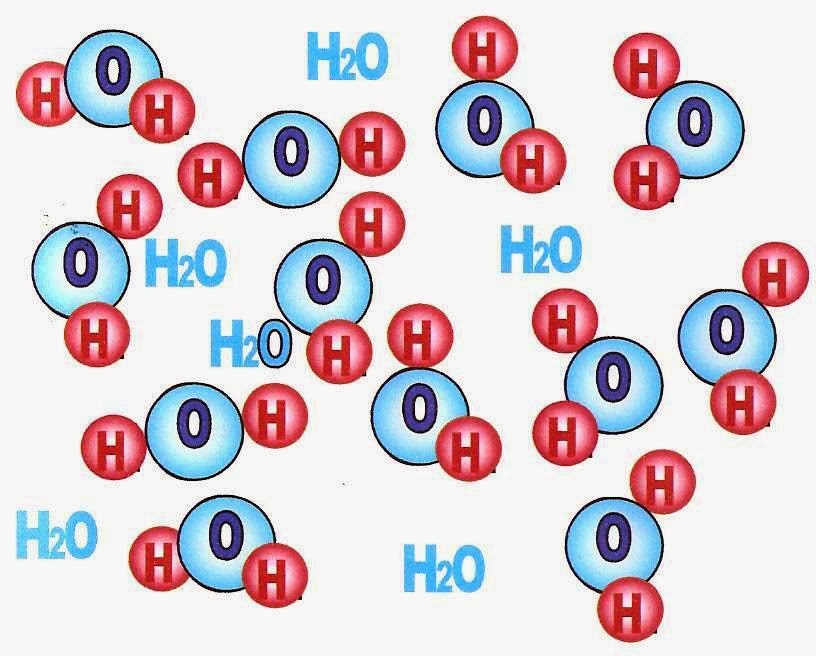
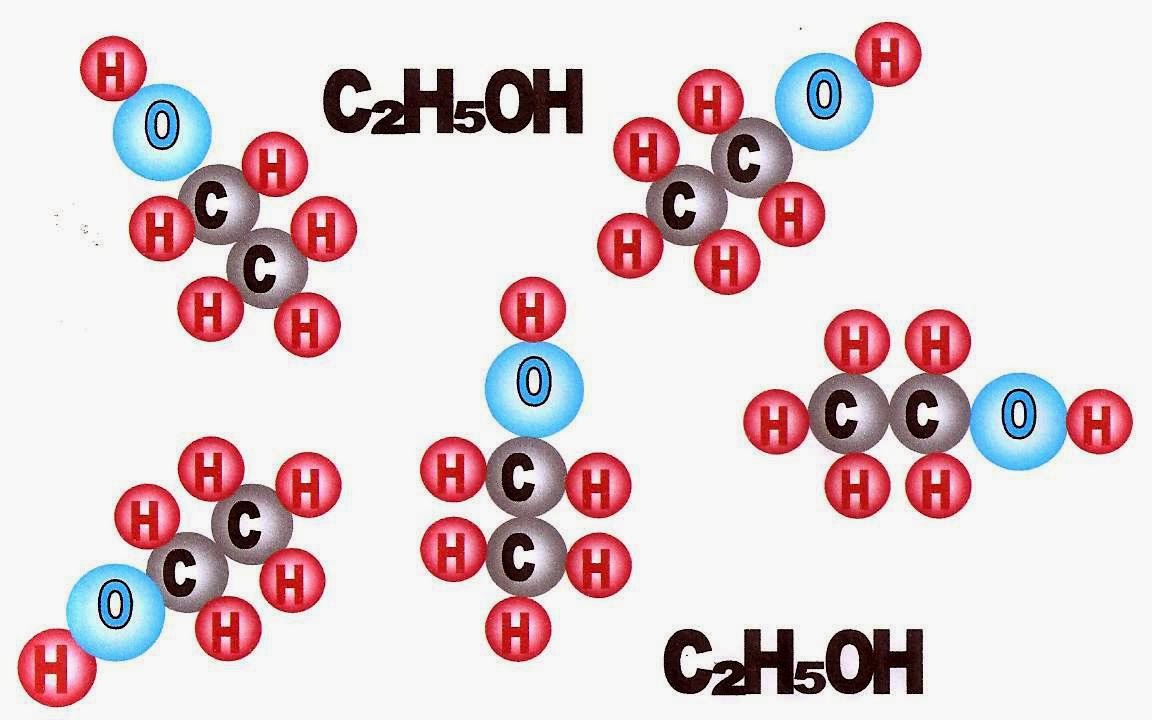
A água (H2O) é formada pelo elemento químico oxigênio e hidrogênio, O álcool é C2H5OH é formado pelo elemento químico carbono, oxigênio e hidrogênio.
O Magnetismo na Formação da Matéria.
A matéria que conhecemos é formada por átomos que podem ser de uma única espécie, por exemplo; o gás hidrogênio puro (H2), formado por dois átomos de hidrogênios, ou ainda por ouro puro (Au) 24 quilates que pode ser transformado em uma barra de ouro, ou mesmo por átomos de diferentes espécies como a água (H2O) que é formada por dois átomos de hidrogênio e um átomo de oxigênio.
Elementos químicos
Átomos

Os elementos químicos são os átomos isolados, como por exemplo; o átomo do elemento químico hidrogênio (H), oxigênio (O), ouro (Au)...etc. O átomo isolado pode formar uma substância. o gás hélio, gás neônio que são gases nobres possuem seus átomos isolados e não formam moléculas. O ouro puro também é uma substância formada por átomos isolados, seus átomos não formam moléculas. Esse elemento químico que forma a substância ouro se liga um ao outro por ligações metálicas criando a matéria sólida ouro puro. Outros átomos de elementos químicos diferentes se ligam formado moléculas e compostos iônicos.


Moléculas
Elementos Químicos Formando Moléculas
A água (H2O) é formada pelo elemento químico oxigênio e hidrogênio, O álcool é C2H5OH é formado pelo elemento químico carbono, oxigênio e hidrogênio.


O Magnetismo na Formação da Matéria.
O movimento dos elétrons de carga negativa, numa órbita fechada gera um dipolo magnético perpendicular ao plano da órbita da carga negativa. São essas rotações que determinam as propriedades magnéticas dos átomos, que se atraem por interação magnética, ou se repelem pelo eletromagnetismo. Portanto a liga da formação da matéria ou das subpartículas de um átomo é o magnetismo.
Características Específicas da Matéria
Interpenetração na Matéria
A matéria forma corpos distintos não se interpenetram portanto, dois corpos não ocupam o mesmo lugar no mesmo espaço ao mesmo tempo.

As Dimensões Próprias dos Corpos
A matéria tem a propriedade aumentar em tamanho os corpos formados, ou de se dividir na formação dos corpos menores de dimensões próprias. Por exemplo uma árvore possui o seu tamanho de crescimento próprio para cada espécie. Qualquer outro corpo adquire forma e tamanho próprios, uma garrafa de vidro para vinho também é um corpo e um objeto modelado para os padrões de uso. Cada tipo de garrafa é uma parte limitada da matéria transformada em vidro com a dimensão apropriada e coerente para o seu uso, uma pedra é um corpo que sendo grande com o tempo se desgasta e vai reduzindo o seu tamanho gerando corpos menores. O ser humano é um corpo, um elefante é um corpo, um camundongo é um corpo, a lua é um corpo celeste, uma bactéria que não enxergamos a olho nú é um corpo.
A Matéria Pode Ser Dividida
Um exemplo é o mármore, rocha metamórfica de origem calcaria especialmente as usadas na exploração comercial se localizam em jazidas ou locais em grandes proporções como em montanhas, encontradas na Itália, Portugal e outros países. Para a extração e comercialização é cortada em blocos que podem ser grandes. Passando a ser industrializado os blocos posteriormente são recortados em placas, que podem sofrer novos cortes em tamanhos adequados e sofrer polimentos e são transformadas em peças artesanais, de revestimento, ou outros usos na construção civil. Dá para entender que esse corpo feito de material específico foi sendo dividido em proporções adequadas. Uma montanha de rochas com o tempo vai se desgastando pela erosão em fragmentos pequenos e transformando em partículas pequenas como os minúsculos grãos de areia e pó.
A Dureza da Matéria
A matéria na formação dos corpos os átomos se combinam para formar a dureza dos materiais. A dureza de cada material se comprova por exemplo, pela capacidade com que um objeto tem para riscar outro objeto. Um gás não tem dureza da qual se possa riscar, a água líquida não tem dureza que se possa riscar, uma gelatina possui o material com que é feito, mole, já pode ser riscada. Um pedaço de madeira de pinho já é mais duro e pode ser riscado ou cortado pelo ferro, o ferro pode ser riscado pelo diamante, que é mais duro que o ferro.
As Transformações da Matéria.
A energia que a própria matéria carrega no seu corpo, em si próprio, ou a energia provinda de outros corpos, (por exemplo do sol) é capaz de transformá-la. Supomos a madeira de uma tábua, provem da transformação de células vegetais que se transformou em fibras e finalmente em uma massa compacta, um tronco, para essas transformações foi necessário receber energia que se desprendeu de outra porção de matéria para essa formação. Prosseguindo as transformações essa madeira pela queima pode ser transformada em carvão que pode ser transformado em gás e cinzas.
Outro exemplo.
Outro exemplo.
Na calcinação para preparação da cal ocorre o consumo de calor e contração do volume do material CaCO3 (calcário), que se transforma em CaO(óxido de cálcio) ou cal virgem.
Calcário + energia térmica (calor) ----reação -----> cal viva (CaO) + gás CO2 .
Nessa transformação do calcário (CaCO3) em cal virgem (CaO) e gás carbônico (CO2), ela se faz através de energia térmica, pela queima do carvão a 900?C ou mais, com redução do volume da massa da matéria prima. Ao reidratar a cal virgem libera energia térmica acumulada e expande seu volume transformando-se em Ca(OH)2.
O calcário dolomítico pode concentrar taxas de cálcio (CaO) 45 a 48% e magnésio (MgO) de 6 a 10% e serve para repor a deficiência desses compostos e para correção do pH do solo.
O calcário dolomítico pode concentrar taxas de cálcio (CaO) 45 a 48% e magnésio (MgO) de 6 a 10% e serve para repor a deficiência desses compostos e para correção do pH do solo.
Corpos
O planeta Terra é um corpo no espaço, uma pedra é matéria e é um corpo, um tronco de madeira é um corpo, o ser humano é um corpo.
Massa
Massa é a medida da quantidade de matéria. A massa dos corpos pode variar, há corpos com massa mais densa,como uma barra de ferro e corpos com massa menos densa o isopor ou um colchão de espuma sintética. O peso de um objeto com a mesma massa pode variar conforme a força da atração da gravidade. Por exemplo o capacete que um astronauta usa aqui na Terra é mais pesado do que quando ele estiver utilizando na lua, na estação orbital esse mesmo capacete não pesará nada porque estará flutuando no ar sem nenhuma força de atração gravitacional. No entanto é o mesmo capacete com a mesma massa.
Corpos Com Massas de Densidades Diferentes
Um corpo com 1000 centímetros cúbicos de água a 25 graus Celsius e 1 atmosfera de pressão pesa aproximadamente 1000 gramas, um corpo de ferro puro com 1000 centímetros cúbicos pesa 7874 gramas.
Volume
É o Espaço ocupado por um corpo gasoso, líquido ou sólido.
Corpos Com Massas de Densidades Diferentes
Um corpo com 1000 centímetros cúbicos de água a 25 graus Celsius e 1 atmosfera de pressão pesa aproximadamente 1000 gramas, um corpo de ferro puro com 1000 centímetros cúbicos pesa 7874 gramas.
Volume
É o Espaço ocupado por um corpo gasoso, líquido ou sólido.
Peso
É a força de atração entre o centro de qualquer corpo e o centro da terra. é a atração gravitacional da terra que dá peso aos corpos.
É a força de atração entre o centro de qualquer corpo e o centro da terra. é a atração gravitacional da terra que dá peso aos corpos.
O peso de um corpo está relacionado ao peso de outro corpo. É o centro de um corpo que atrai o centro de outro corpo e que lhe dá o peso conforme a força dessa atração. A matéria se torna pesada sob a força da atração da gravidade. A gravidade de um corpo se dá pela sua rotação. A rotação em torno de um eixo pode ser exercida por corpos celestes como o sol que possui o seu próprio eixo, ou por planetas como mercúrio, Vênus, ou a Terra que gira em torno de seu próprio eixo próprio criando a força da atração gravitacional, dando peso a todos os corpos que estão em contato com a sua superfície.
Peso é a força de atração pela gravidade de um corpo em relação ao centro da Terra. É a gravidade da Terra que dá peso aos corpos.
As medidas de peso que adotamos no nosso pais são: tonelada, quilograma, grama, miligrama etc.
Objetos
Objeto é um pedaço de matéria trabalhado pelo ser humano que serve para ser usado adequadamente. A cadeira, uma mesa são objetos, uma faca colheres e garfos de cozinha são objetos, uma geladeira, televisão e um rádio um relógio ou uma balança são objetos.
uma porca e o parafuso, o martelo, a chave de fenda é um objeto, um lápis ou uma caneta são objetos, o ferro de passar roupas. Outros mais sofisticados como o celular, o microondas, o computador, o carro são montados por um número grande de peças que são objetos menores que vão se encaixando um no outro até formarem o outro mais complexo feito de diversos materiais, um foguete que sobe para o espaço é um objeto.
Massa e Densidade da Matéria
Cada espécie da matéria possui a sua própria densidade, portanto cada corpo tem a sua própria massa, os gases são muito pouco densos no seu estado natural.
Os materiais mais pesados possuem mais densidade, enquanto que os materiais menos pesados possuem menos densidade. Um centímetro cubico de uma substância no estado gasoso possui menos densidade que um centímetro cubico de água líquida, que possui massa menos densa que um centímetro cúbico de ferro metálico.
A água liquida a zero grau Celsius possui a densidade de 0,99984 g/cm3, a 4 graus Celsius a densidade é de 1,0000 g/cm3, a 10 graus Celsius a sua densidade é de 0,99970, a 30 graus Celsius possui a densidade de 0,99565 g/cm3, a mesma água sólida (congelada) possui outra densidade, uma bolinha de isopor possui menor densidade que uma bolinha de ferro do mesmo tamanho.
A densidade muda de elemento químico para elemento químico, ou de material para material, a densidade do mercúrio, metal líquido é 13,1 g/cm3, bem maior que a densidade do ferro sólido 7,87 g/cm3, a densidade do ouro é 19,3 g/cm3, a densidade do metal ósmio é 22,61 g/cm3 muito maior que a do ferro.
Objetos
Objeto é um pedaço de matéria trabalhado pelo ser humano que serve para ser usado adequadamente. A cadeira, uma mesa são objetos, uma faca colheres e garfos de cozinha são objetos, uma geladeira, televisão e um rádio um relógio ou uma balança são objetos.
uma porca e o parafuso, o martelo, a chave de fenda é um objeto, um lápis ou uma caneta são objetos, o ferro de passar roupas. Outros mais sofisticados como o celular, o microondas, o computador, o carro são montados por um número grande de peças que são objetos menores que vão se encaixando um no outro até formarem o outro mais complexo feito de diversos materiais, um foguete que sobe para o espaço é um objeto.
Massa e Densidade da Matéria
Cada espécie da matéria possui a sua própria densidade, portanto cada corpo tem a sua própria massa, os gases são muito pouco densos no seu estado natural.
Os materiais mais pesados possuem mais densidade, enquanto que os materiais menos pesados possuem menos densidade. Um centímetro cubico de uma substância no estado gasoso possui menos densidade que um centímetro cubico de água líquida, que possui massa menos densa que um centímetro cúbico de ferro metálico.
A água liquida a zero grau Celsius possui a densidade de 0,99984 g/cm3, a 4 graus Celsius a densidade é de 1,0000 g/cm3, a 10 graus Celsius a sua densidade é de 0,99970, a 30 graus Celsius possui a densidade de 0,99565 g/cm3, a mesma água sólida (congelada) possui outra densidade, uma bolinha de isopor possui menor densidade que uma bolinha de ferro do mesmo tamanho.
A densidade muda de elemento químico para elemento químico, ou de material para material, a densidade do mercúrio, metal líquido é 13,1 g/cm3, bem maior que a densidade do ferro sólido 7,87 g/cm3, a densidade do ouro é 19,3 g/cm3, a densidade do metal ósmio é 22,61 g/cm3 muito maior que a do ferro.
A Compressibilidade da Matéria
A matéria pode sofrer compressibilidade e reduzir o seu volume ao sofrer pressão uniforme por todos os lados. Os gases são os materiais que podem ser comprimido facilmente. Os líquidos e os sólidos sofrem muito pouca compressibilidade. Poderíamos imaginar as moléculas de água nas profundezas oceânicas, sofrendo o efeito da pressão de centenas de atmosferas e comprimidas pelo seu próprio peso, ou ainda o magma no centro da Terra sofrendo milhares de atmosferas de compressão, no entanto a redução do seu volume por essa compressão seria muito pequena.
Saindo do nosso habitat e indo para o interior do núcleo das grandes estrelas, podemos imaginar que os elementos químicos, ou as moléculas sofrem pressões de milhões de atmosferas, portanto são comprimidas umas contra as outras com a diminuição dos espaços ou distâncias entre cada uma das partículas.
Divisibilidade
Divisibilidade
A matéria tem a propriedade de se dividir. Por exemplo uma montanha rochosa vai sofrendo desgaste pelo tempo pela ação dos ventos, da água, do frio e do calor, por erosão de ácidos ou por erosão orgânica, vai se desgastando quebrando em grandes blocos de pedras em pequenos grãos de areia, em minúsculas partículas de tamanho molecular ou de íons retirados para utilização dos seres vivos microscópicos locais, fungos, algas, bactérias etc. A divisibilidade da matéria não para aí; até os átomos podem ser divididos.
Solubilidade
Outra propriedade da matéria é a solubilidade, a matéria dilui matéria. A água é o solvente solvente universal para uma grande quantidade de solutos.
A água (H2O) é bom solvente para o cloreto de sódio NaCl a solubilidade em 100 g de água é de 36 g a 25 graus Celsius.
A água (H2O) é bom solvente para o sulfato de magnésio (MgSO4) a solubilidade em 100 g de água é de 36 g a 25 graus Celsius.
A água (H2O) é bom solvente para o brometo de sódio (NaBr)) a solubilidade em 100 g de água é de 120,0 g a 25 graus Celsius.
A água (H2O) é mau solvente para o carbonato de cálcio (CaCO3)) a solubilidade em 100 g de água é de 0,0013 g a 25 graus Celsius.
A água (H2O) é mau solvente para o sulfato de cálcio (CaSO4)) a solubilidade em 100 g de água é de 0,068 g a 25 graus Celsius.
Materiais
Quando vamos construir uma casa não dizemos: vamos comprar materiais para a construção. Quais são esses materiais? Cimento, tijolos, cal, areia, pedras britadas, a tinta, o ferro para fazer as vigas e amarrações de concreto. Os ingredientes para se fazer um bolo a farinha de trigo, o fermento os ovos, o leite, a manteiga ou margarina, o açúcar, o sal, as essências também são materiais.
A figura ao lado mostra a construção civil ao fundo que utiliza muitos tipos de materiais diferentes. O ferro, o cimento a cal, areia, pedras britadas, a madeira, fios e cabos elétricos, argamassas para várias colagens de materiais como pisos e revestimentos de paredes, porcelanatos, vidros, plásticos, borrachas, tintas.
Matéria Prima
Matéria Prima
A matéria prima pode sofrer transformação e gerar um produto. Por exemplo; a bauxita é a matéria prima para obtenção do alumínio, o calcário é a matéria prima para a fabricação da cal, o carvão é matéria prima na produção do ferro e aço, o hidróxido de sódio é matéria prima na fabricação de sabões e por sua vez o cloreto de sódio é a matéria prima para a fabricação por eletrólise do hidróxido de sódio, a hematita é a matéria prima para a fabricação do ferro gusa que por sua vez é a matéria prima para a fabricação do aço.
Estados Físicos da Matéria
Estado Gasoso da Matéria

A figura ao lado mostra o esquema das moléculas de água no estado gasoso. Podemos observar que as moléculas nesse estado físico se encontram mais afastadas uma das outras.
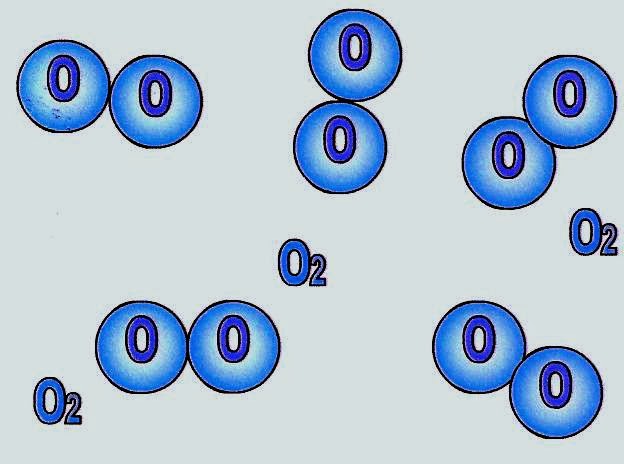 Gás Oxigênio
Gás Oxigênio
O esquema ao lado mostra as moléculas de gás oxigênio.
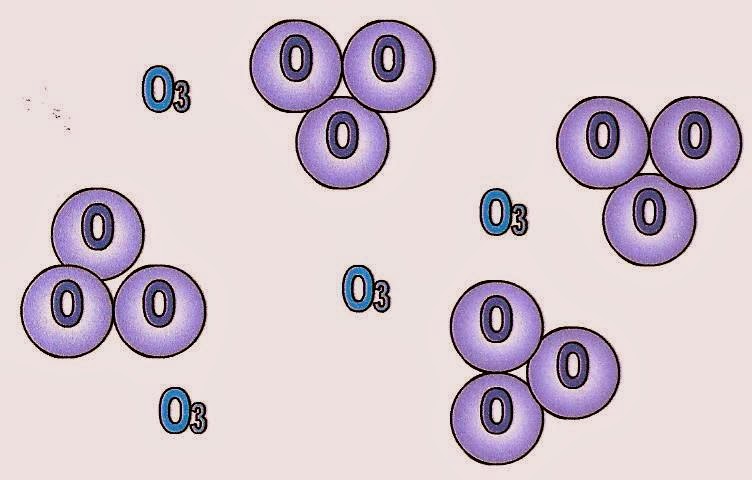
Esquema das moléculas do gás ozônio.
O ar atmosférico com a sua diversidade de gases é o melhor exemplo de estado gasoso da matéria. O ar atmosférico é formado pelo gás nitrogênio (N2) 78 %, gás oxigênio 20 %, argônio Ar 1 %, neônio (Ne) 0,0018 %, Hélio (He) 0,0005%, hidrogênio 0,00005 %, xenônio (Xe) 0,0000086.
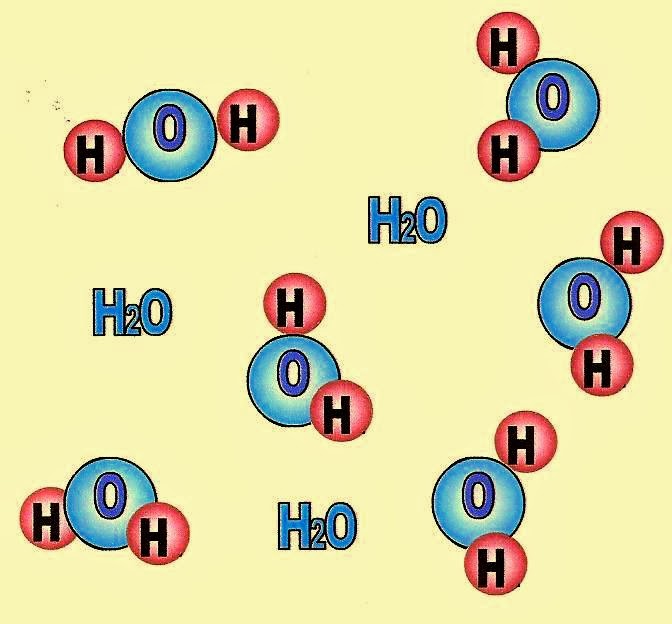
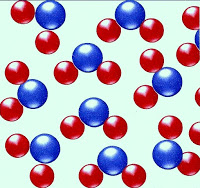
Estado Líquido da Matéria
A figura logo abaixo mostra o esquema das moléculas da água no estado líquido. Observe que as moléculas estão mais próximas uma das outras.
Estado Sólido da Matéria
No estado sólido a matéria se apresenta com os átomos mais próximos um do outro.
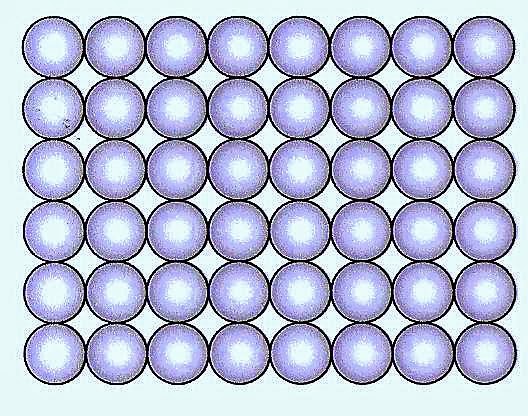
Esquema representativo de átomos alinhados de um metal.
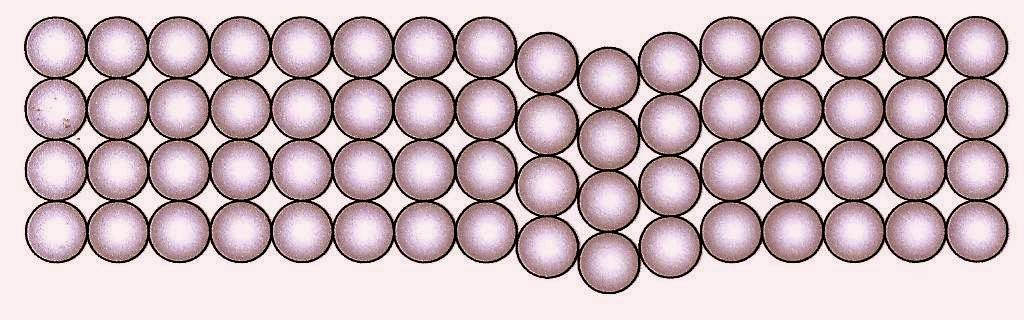
O esquema abaixo representa átomos de um metal amassado.

O gás ozônio é uma substância simples porque é formado por três átomos de oxigênio.
Substâncias Compostas
São substâncias formadas por mais de um tipo de átomo.
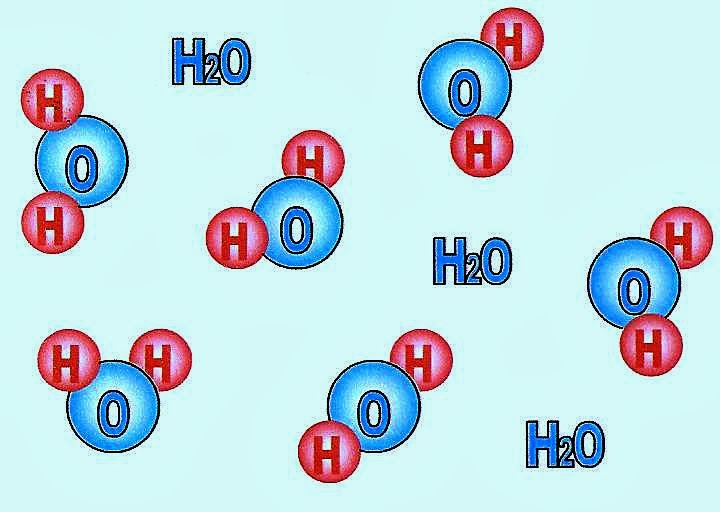
A água é uma substância composta porque é formada por mais de uma especie de átomo. Os átomos que compõem a molécula de água são o oxigênio e o hidrogênio. Além dos diversos gases diluídos a água potável ou a água mineral comercializada ainda pode conter: sais cloreto de sódio, bicarbonato, sulfato, nitrato, cloreto, fluoreto,cálcio, zinco, magnésio, cobre, estrôncio, bário, fosfato.
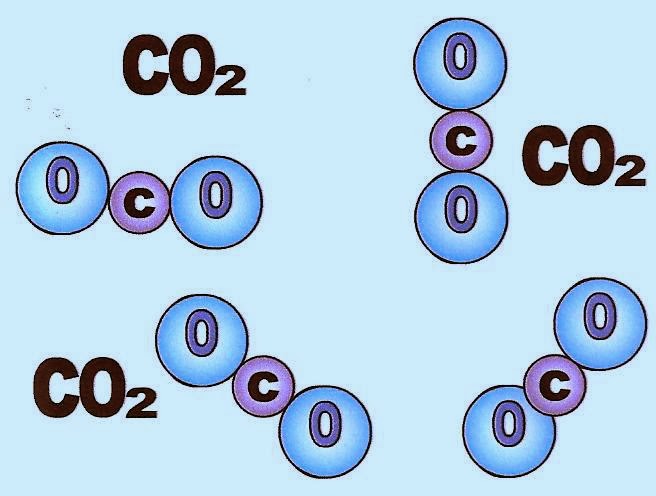
 O gás carbônico (CO2) é uma substância composta formada por dois átomos de oxigênio e um átomo de carbono.
O gás carbônico (CO2) é uma substância composta formada por dois átomos de oxigênio e um átomo de carbono.
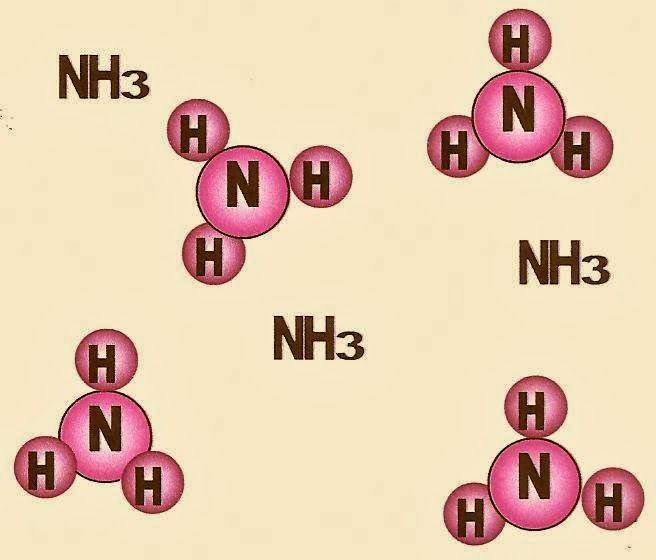
Gás amônia (NH3) substância composta. A molécula do gás amônia é composta por dois tipos de elementos químicos diferentes, o átomo de nitrogênio e o átomo de hidrogênio.
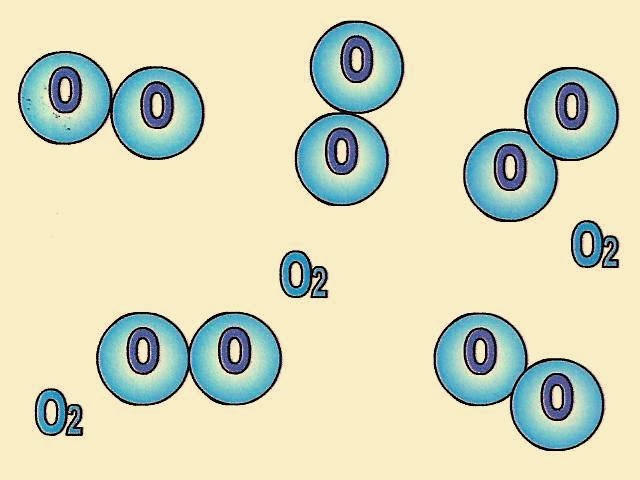
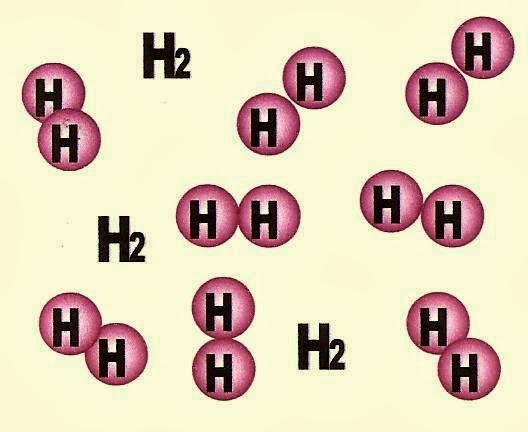
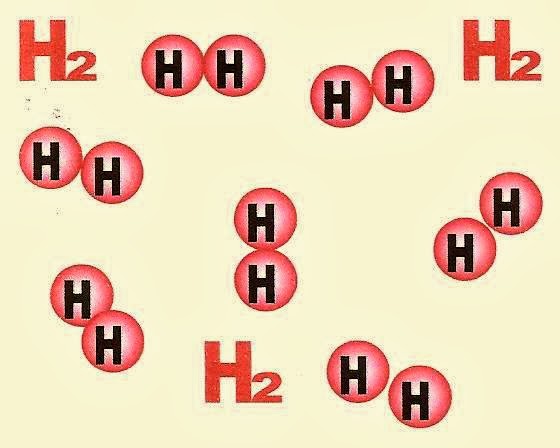
Figuras representativas do gás oxigênio á esquerda e gás hidrogênio á direita.
Substância Simples, Pura, Homogênea

O esquema ao lado mostra as moléculas de gás oxigênio.

Esquema das moléculas do gás ozônio.
O ar atmosférico com a sua diversidade de gases é o melhor exemplo de estado gasoso da matéria. O ar atmosférico é formado pelo gás nitrogênio (N2) 78 %, gás oxigênio 20 %, argônio Ar 1 %, neônio (Ne) 0,0018 %, Hélio (He) 0,0005%, hidrogênio 0,00005 %, xenônio (Xe) 0,0000086.
Estado Líquido da Matéria
A figura logo abaixo mostra o esquema das moléculas da água no estado líquido. Observe que as moléculas estão mais próximas uma das outras.

Estado Sólido da Matéria
No estado sólido a matéria se apresenta com os átomos mais próximos um do outro.

Esquema representativo de átomos alinhados de um metal.
O esquema abaixo representa átomos de um metal amassado.

Substâncias
É característica de uma substância pura ter propriedades físicas bem definidas. Essas propriedades são o ponto de fusão de ebulição, densidade. Pode-se se acrescentar ainda para certas substâncias, a solubilidade a determinado solvente.
Substâncias Simples
Substâncias simples são aquelas que são formadas por uma única espécie de elemento químico.

Átomos do gás hélio. O gás hélio é um gás nobre que no estado natural gasoso suas partículas se encontram isolados.

O gás oxigênio é uma substância simples porque é formado somente por átomos de oxigênio.
O gás hidrogênio é uma substância simples.
Substâncias simples são aquelas que são formadas por uma única espécie de elemento químico.

Átomos do gás hélio. O gás hélio é um gás nobre que no estado natural gasoso suas partículas se encontram isolados.


O gás oxigênio é uma substância simples porque é formado somente por átomos de oxigênio.
O gás hidrogênio é uma substância simples.

O gás ozônio é uma substância simples porque é formado por três átomos de oxigênio.
Substâncias Compostas
São substâncias formadas por mais de um tipo de átomo.

A água é uma substância composta porque é formada por mais de uma especie de átomo. Os átomos que compõem a molécula de água são o oxigênio e o hidrogênio. Além dos diversos gases diluídos a água potável ou a água mineral comercializada ainda pode conter: sais cloreto de sódio, bicarbonato, sulfato, nitrato, cloreto, fluoreto,cálcio, zinco, magnésio, cobre, estrôncio, bário, fosfato.

 O gás carbônico (CO2) é uma substância composta formada por dois átomos de oxigênio e um átomo de carbono.
O gás carbônico (CO2) é uma substância composta formada por dois átomos de oxigênio e um átomo de carbono.Gás amônia (NH3) substância composta. A molécula do gás amônia é composta por dois tipos de elementos químicos diferentes, o átomo de nitrogênio e o átomo de hidrogênio.
Substâncias Puras
É característica de uma substância pura ter propriedades físicas bem definidas. Essas propriedades são o ponto de fusão de ebulição, densidade. Pode-se se acrescentar ainda para certas substâncias a solubilidade que somente ela possui a determinado solvente.
É característica de uma substância pura ter propriedades físicas bem definidas. Essas propriedades são o ponto de fusão de ebulição, densidade. Pode-se se acrescentar ainda para certas substâncias a solubilidade que somente ela possui a determinado solvente.
Substâncias Puras e Simples
Nas substâncias puras todos os átomos ou moléculas de uma substância são iguais, não há nenhum outro tipo de átomo ou molécula de outra substância misturada. Exemplos:
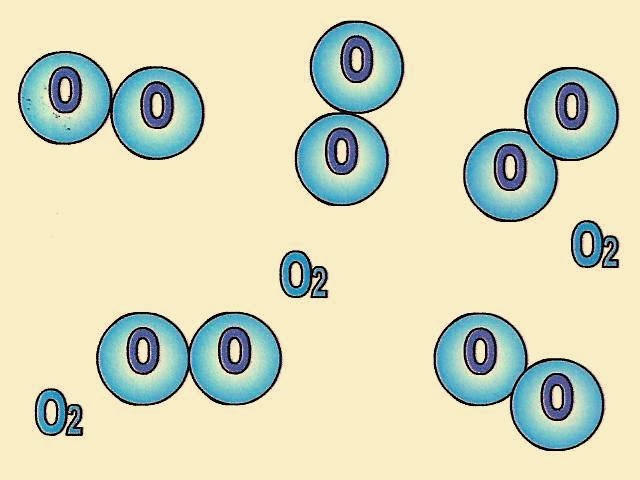

Figuras representativas do gás oxigênio á esquerda e gás hidrogênio á direita.
Substância Simples, Pura, Homogênea

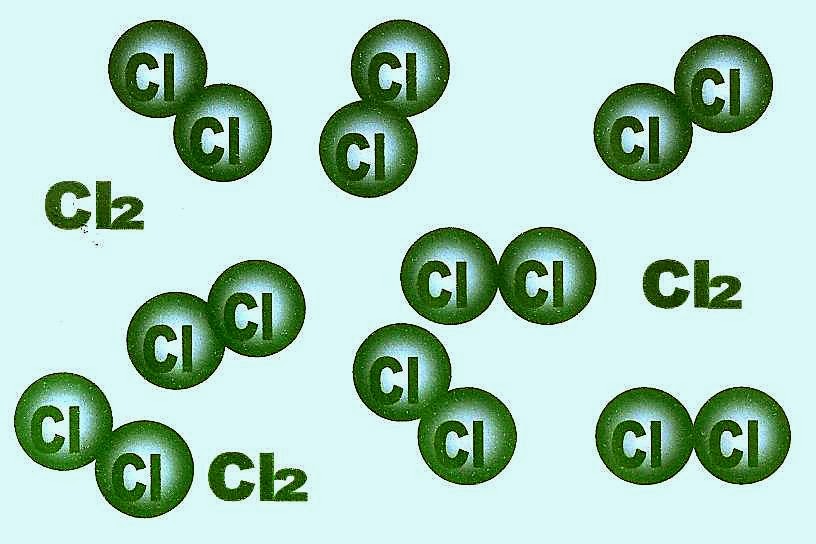
O gás cloro (Cl2) com o ponto de fusão -34ºC é uma substância simples, pura, produzido industrialmente por decomposição eletrolítica do cloreto de sódio. Na natureza o cloro não é encontrado no estado puro, está sempre ligado a outro elemento químico pois é muito reativo e forma cloretos, cloratos ou se combina com o hidrogênio formando o ácido clorídrico. Quando liberado no ambiente pode formar nuvens de vapor de cor amarelo esverdeado de odor desagradável, corrosivo para os olhos, pode causar lacerações na pele, é altamente tóxico para uma pessoa que estiver em um ambiente fechado. Esse gás é mais pesado que a água pode se acumular em lugares próximo ao nível do solo.
Misturas
Misturas Homogêneas
O ar que nos envolve é uma mistura de vários gases, gás nitrogênio, gás oxigênio, gás argônio, gás hélio, gás hidrogênio, gás carbônico, gás ozônio.
A água potável que nós bebemos.
O álcool comercial é uma mistura de 42% de etanol e 58% de água.
Misturas Heterogêneas
Óleo, água, areia.
Granito ? quartzo, feldspato e mica.
Misturas Heterogêneas
Óleo, água, areia.
Fumaça.
O sangue humano ou de qualquer animal de sangue quente.
O leite.
A Fumaça Como Mistura Heterogênea
Cada tipo de fumaça tem uma composição química diferente, depende muito do que está queimando. Por exemplo, a fumaça de um pneu queimando tem a composição diferente da queima do carvão, que é diferente para o carvão mineral e vegetal. O que há de comum nos diferentes casos é que em todos eles formam na fumaça partículas de carbono solidificada (carvão). Plásticos quando misturados num incêndio de uma loja de departamentos, dão outro tipo de fumaça. A fumaça da queimada de cana-de-açúcar produz a fumaça que nós enxergamos a olho nu, é formada por partículas sólidas e aglomerados visíveis de partículas no estado líquido a água, portanto seu conjunto de substâncias componentes não estão somente no estado gasoso mas também no sólido e líquido, no entanto estão todas misturadas no conjunto dos vários tipos de partículas de substâncias componentes. O material particulado sólido liberado pela queima, também como os demais é inalável por nós seres humanos e podem ser prejudiciais num curto espaço de tempo ou a longo prazo. A fuligem cuja substância principal é o carvão aglomerado é o mais visível das partículas que observamos e causa problemas respiratórios imediatos; irritação nos olhos, nariz e garganta, tosse, sintomas alérgicos etc, além desses particulados, há também a água e outros gases; o dióxido de carbono na forma gasosa e outros componentes, os óxidos de nitrogênio, dióxido de nitrogênio (NO2) e monóxido de carbono (CO) partículas de benzopireno, benzofluoranteno, benzoantracenoe benzofenantreno, compostos bem oxidados ou queimados o nitrogênio (N2) o dióxido de enxofre (SO2) que pode formar chuva ácida, outros compostos podem não ser oxidados completamente por falta de oxigênio suficiente, nesse caso estão o metano e a amônia que são formados.
A Fumaça Como Mistura Heterogênea
Cada tipo de fumaça tem uma composição química diferente, depende muito do que está queimando. Por exemplo, a fumaça de um pneu queimando tem a composição diferente da queima do carvão, que é diferente para o carvão mineral e vegetal. O que há de comum nos diferentes casos é que em todos eles formam na fumaça partículas de carbono solidificada (carvão). Plásticos quando misturados num incêndio de uma loja de departamentos, dão outro tipo de fumaça. A fumaça da queimada de cana-de-açúcar produz a fumaça que nós enxergamos a olho nu, é formada por partículas sólidas e aglomerados visíveis de partículas no estado líquido a água, portanto seu conjunto de substâncias componentes não estão somente no estado gasoso mas também no sólido e líquido, no entanto estão todas misturadas no conjunto dos vários tipos de partículas de substâncias componentes. O material particulado sólido liberado pela queima, também como os demais é inalável por nós seres humanos e podem ser prejudiciais num curto espaço de tempo ou a longo prazo. A fuligem cuja substância principal é o carvão aglomerado é o mais visível das partículas que observamos e causa problemas respiratórios imediatos; irritação nos olhos, nariz e garganta, tosse, sintomas alérgicos etc, além desses particulados, há também a água e outros gases; o dióxido de carbono na forma gasosa e outros componentes, os óxidos de nitrogênio, dióxido de nitrogênio (NO2) e monóxido de carbono (CO) partículas de benzopireno, benzofluoranteno, benzoantracenoe benzofenantreno, compostos bem oxidados ou queimados o nitrogênio (N2) o dióxido de enxofre (SO2) que pode formar chuva ácida, outros compostos podem não ser oxidados completamente por falta de oxigênio suficiente, nesse caso estão o metano e a amônia que são formados.
Fenômenos da Matéria
Fenômenos Físicos
Evaporação da água
Evaporação do álcool
Evaporação da acetona
Ventania
Fenômenos Químicos - Transformações Químicas
 Transformações da Matéria
Transformações da Matéria
Queimar do gás de cozinha
Evaporação da acetona
Ventania
Fenômenos Químicos - Transformações Químicas
Queimar do gás de cozinha
Carvão queimando.
A ferrugem corroendo o ferro.
Amadurecimento de uma fruta.
A ferrugem corroendo o ferro.
Amadurecimento de uma fruta.
Comprimido efervescente dissolvendo na água.
Fogos de artifício.
Queima de uma vela.
Queima de uma vela.
É a combustão da parafina que gera energia térmica e energia luminosa com a produção de gás carbônico (CO2) e água (H2O).
Exercícios
1) O estado físico da matéria que passa do líquido para o gasosos é chamado de:
a) fusão.
b) decantação.
c) destilação.
d) ebulição.
solidificação.
2) As moléculas que representam substâncias compostas estão localizadas apenas na alternativa:
a) N2; O3; NH3; H2O.
b) O2; H2O; O3; Cl2.
c) O3; O2; N2; Cl2.
d) CO2; NH3; H2O; CH4.
e) Cl2; O3; N2; C2H5OH .
c) Álcool e água.
d) Café coado.
3) Podemos considerar uma mistura heterogênea apenas a alternativa.
a) O ar atmosférico.
b) A água mineral.c) Álcool e água.
d) Café coado.
e) O sangue humano.
4) O gás que fica numa altitude atmosférica de 30 a 50 quilômetros , filtra a radiação ultravioleta emitida pelo sol, é extremamente oxidante e reativo, ao nível do solo pode ser tóxico. Pode ser usado como germicida esterilizante; bactericida e antifúngico é usado em terapias da osteomielite , na isquemia cardiopática, insuficiência renal e ainda atua estabilizando o metabolismo do oxigênio é o:
a) oxigênio.
b) hidrogênio.
c) ozônio.
d) carbônico.
e) hélio.
b) N2; O2; O3; H2; CO2.
c) H2; He; CH4; SiO2. CaCO3
d) NaCl; CaO, CO2; H2O; Fe
e) He; CaO; C2H5OH; CuO.
6) Um dos fenômenos físicos que acontece com a matéria é o de reduzir o seu volume ao sofrer pressão uniforme por todos os lados. A esse fenômeno damos o nome de:
a) Elasticidade. da matéria.
b) Compressibilidade da matéria.
c) Divisibilidade da matéria.
d) Descontinuidade da matéria.
e) Impenetrabilidade da matéria.
4) O gás que fica numa altitude atmosférica de 30 a 50 quilômetros , filtra a radiação ultravioleta emitida pelo sol, é extremamente oxidante e reativo, ao nível do solo pode ser tóxico. Pode ser usado como germicida esterilizante; bactericida e antifúngico é usado em terapias da osteomielite , na isquemia cardiopática, insuficiência renal e ainda atua estabilizando o metabolismo do oxigênio é o:
a) oxigênio.
b) hidrogênio.
c) ozônio.
d) carbônico.
e) hélio.
5) As substâncias que estão no estado gasosos á temperatura ambiente são:
a) Hg; NaCl; NaOH, CO2; CO.b) N2; O2; O3; H2; CO2.
c) H2; He; CH4; SiO2. CaCO3
d) NaCl; CaO, CO2; H2O; Fe
e) He; CaO; C2H5OH; CuO.
6) Um dos fenômenos físicos que acontece com a matéria é o de reduzir o seu volume ao sofrer pressão uniforme por todos os lados. A esse fenômeno damos o nome de:
a) Elasticidade. da matéria.
b) Compressibilidade da matéria.
c) Divisibilidade da matéria.
d) Descontinuidade da matéria.
e) Impenetrabilidade da matéria.
7) A mistura heterogênea formada por partículas sólidas, líquidas e gasosas, misturadas num conjunto com material particulado inalável e fuligem, que é aglomerado de partículas de carbono, água, dióxido e monóxido de carbono e outros componentes, os óxidos de nitrogênio (NO), dióxido de nitrogênio (NO2) e monóxido de carbono (CO) partículas de benzopireno, benzofluoranteno, benzoantraceno e benzofenantreno, compostos bem oxidados N2, SO2, compostos não oxidados completamente por falta de oxigênio suficiente o metano a amônia é:
a) A água do mar.
b) Gás de cozinha.
c) Petróleo.
d) Água mineral,
e) Fumaça.
8) O gás que é uma substância simples, pura, homogênea e quando liberado no ambiente pode formar nuvens de vapor de cor amarelo esverdeado de odor desagradável, corrosivo para os olhos, pode causar lacerações na pele, é altamente tóxico para uma pessoa que estiver em um ambiente fechado. Esse gás é mais pesado que a água, pode se acumular em lugares próximo ao nível do solo. O gás do qual estamos falando é o:
a) gás nitrogênio (N2).
b) gás hidrogênio (H2)
c) gás argônio (Ar).
d) gás cloro (Cl2).
e) gás oxigênio (O2).
9) O peso de um corpo pode ser definido como.
a)A matéria que se torna pesada sob a força da atração da sua própria densidade, quanto mais densos os corpos mais se atraem.
b) A matéria que se torna pesada sob a força da atração quantidade de matéria que cada corpo possui individualmente.
c) A matéria que se torna pesada sob a força da atração da gravidade do centro de um corpo que atrai o centro de outro corpo.
d) A matéria que se torna pesada sob a força da compressibilidade ao reduzir o seu volume e sofrer pressão uniforme.
e) A matéria que se torna pesada sob a força da propriedade de se dividir. Quanto mais se divide mais é atraída pelo centro de um corpo.
a) MgCl2 54,1 g e NaBr) 6,8 x 10-2 g
b) NaBr 1,2 x 10+2 g e CaCO3 1,3 x10-3 g.
c) NaBr 1,2 x 10+2 g e MgSO4 36,0 g.
d) CaCO3 1,3 x10-3 g e CaSO4 6,8 x 10-2 g.
e) NaBr 1,2 x 10+2 g e MgCl2 54,1 g
Texto: Antonio Spereta Rocha
10) Foram realizadas experiências da água como solvente para alguns solutos. Nos testes 100 gramas de água dissolveu completamente a 25 Graus Celcius: cloreto de sódio (NaCl) 36,0 g, cloreto de magnésio (MgCl2) 54,1 g, sulfato de magnésio (MgSO4) 36,0 g, sulfato de cálcio( CaSO4) 6,8 x 10-2 g, brometo de sódio (NaBr) 1,2 x 10+2 g, carbonato de cálcio (CaCO3) 1,3 x10-3 g.
Dos solutos que foram dissolvidos na água é o mais solúvel e o menos solúvel:a) MgCl2 54,1 g e NaBr) 6,8 x 10-2 g
b) NaBr 1,2 x 10+2 g e CaCO3 1,3 x10-3 g.
c) NaBr 1,2 x 10+2 g e MgSO4 36,0 g.
d) CaCO3 1,3 x10-3 g e CaSO4 6,8 x 10-2 g.
e) NaBr 1,2 x 10+2 g e MgCl2 54,1 g
Texto: Antonio Spereta Rocha
loading...
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Átomos - Hidrogênio
Os Elementos Químicos da Tabela Periódica Os Elementos Químicos Os elementos químicos, podem ser descritos como as partículas básicas formadoras de toda a matéria que conhecemos. Os elementos químicos naturais conhecidos pelo...
- Comentários - A Produção Da Cal
Professor:...
- Questões 1a Série Caderno Do Aluno Vol.1
...
- A Matéria E Suas Transformações
A Definição de Matéria Transformações ...
