Química
Isótopos
Podemos definir isótopos, sendo átomos de um mesmo elemento químico com massas diferentes e com o mesmo número atômico. O isótopo que corresponde a massa presente na tabela periódica,é sempre o de mais longa duração do tempo de vida e o mais abundante na natureza.
Um Único Isótopo Natural
Exemplos de Isótopos .
- Lítio
Lítio - Li O lítio é o terceiro elemento químico da tabela periódica na sequência dos números atômicos. A Descoberta do...
- Hélio
O Hélio - He O hélio a nível atômico é o elemento químico número dois da tabela periódica a descoberta desse elemento químico...
- Como Se Determina A Idade De Um FÓssil
Bolsista: Roniel FranciscoOlá pessoal do QUIPIBID, nessa semana, na coluna de atualidades, vamos falar um pouco sobre uma matéria do portal G1, exibida dia 15/11/13, que relata o surgimento do cachorro doméstico na Europa, há pelo menos 19 mil anos...
- Isótopos, Isóbaros E Isótonos
Bolsista: Litton Jr.Olá amigos do QUIPIBID! Essa semana na nossa coluna de dicas de vestibular iremos falar sobre os isótonos, isóbaros e isótonos, o conteúdo é curto e de facil compreensão, mas para isso é necessário entender algumas características...
- Avaliação De Química Nº 2 - Isótopos - Isóbaros E Isótonos
1) São dados três átomos genéricos A, B e C. O átomo A tem número atômico 78 e número de massa 174. O átomo C tem 98 nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A. O número de elétrons do átomo B é: 2) São...
Química
Isótopos
Isótopos
Podemos definir isótopos, sendo átomos de um mesmo elemento químico com massas diferentes e com o mesmo número atômico. O isótopo que corresponde a massa presente na tabela periódica,é sempre o de mais longa duração do tempo de vida e o mais abundante na natureza.
Um Único Isótopo Natural
A maioria dos átomos conhecidos possuem dois ou mais isótopos naturais, porém há uma série de elementos químicos na natureza que são encontrados somente na forma de um único tipo de isótopo. São eles:
Berílio (4Be9); flúor (9F19); sódio (11Na23); alumínio (13Al27); fósforo (15P31); escândio (21Sc45); manganês (25Mn55); cobalto (27Co59); arsênio (33As75); ítrio (39Y89); nióbio (41Nb93); ródio (45Rh103); iodo (53I127); Césio (55Cs133); promécio (61Pr141); térbio (65Tb159); hólmio (67Ho165); túlio (69Tm168); ouro (79Au197); bismuto (83Bi209).
Exemplos de Isótopos .
Os exemplos de Isótopos citados abaixo correspondem aos isótopos encontrados em percentuais na natureza.
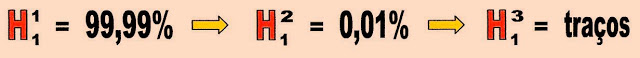
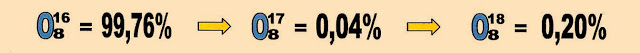
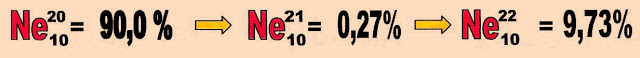
Isótopos de lítio
Os isótopos naturais do elemento químico lítio são dois.

Isótopos de cloro
Os isótopos naturais do elemento químico cloro são dois.

Isótopos do cobre


Isótopos de urânio
Os isótopos naturais do elemento químico urânio são três.
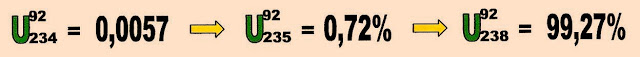
Isótopos de hidrogênio
Os isótopos do elemento químico hidrogênio são três, o hidrogênio de massa 1, deutério de massa 2 e o trítio de massa 3.
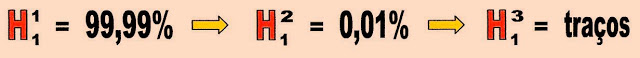
Isótopos de oxigênio
Os isótopos naturais do elemento químico oxigênio são três.
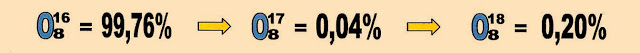
Isótopos de neônio
Os isótopos naturais do elemento químico neônio são três.
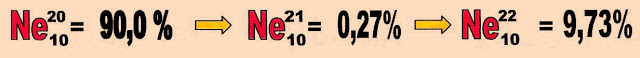
Os isótopos naturais do elemento químico lítio são dois.

Lítio na Produção de Combustível Trítio
O lítio pode ser utilizado para a produção industrial de trítio. A sua produção se dá pelo bombardeamento do lítio de massa 6 por um nêutron. Na reação, o nêutron cindi o lítio em duas partes, seus produtos formandos são, hélio de massa 4 (2He4) e um átomo de trítio (1H3). Esse trítio é utilizado como propelente para foguetes que são usados como arma nuclear.
Isótopos de cloro
Os isótopos naturais do elemento químico cloro são dois.

Isótopos do cobre

Isótopos de rubídio
Os isótopos naturais do elemento químico rubídio são dois.

Isótopos de urânio
Os isótopos naturais do elemento químico urânio são três.
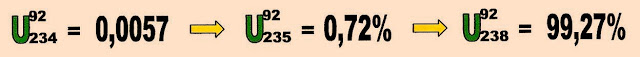
A Utilização Dos Isótopos
A Utilidade do Isótopo Deutério (D2)
Como temos conhecimento o elemento químico deutério tem o seu núcleo formado por um próton e um nêutron, diferentemente do hidrogênio comum, que só tem um próton no seu núcleo.
Portanto assim se distingue o isótopo do deutério ou hidrogênio de massa dois, cuja proporção apresentada na natureza é de aproximadamente 0,02 %, o qual é formador da água pesada. Tem sua importância econômica também, porque é utilizado em reatores nucleares no seu resfriamento, na fusão nuclear juntamente com o trítio, por ser muito eficaz nesse tipo de reação, tem o seu uso na fabricação de lâmpadas especiais, de espectrômetros e espectrofotômetros que são aparelhos comuns de laboratórios de análises. Outro aproveitamento desse isótopo é por estar inserido juntamente com outro isótopo estável, o oxigênio de massa 18, ambos presentes nos aqüíferos e nos dispositivos dos aparelhos de localização dessas fontes de reservas de água, de uso, principalmente nos países desenvolvidos e no Nordeste Brasileiro onde se pesquisa os recursos hídricos.
Isótopo de Cobalto (Co60)
O Isótopo ou radioisótopo de Cobalto 60 é obtido artificialmente, pelo bombardeamento do isótopo 59 com nêutrons. O excesso de nêutrons torna o seu núcleo instável e se desintegra num tempo menor, liberando a radiação. Esse isótopo tem estabilidade de meia vida de aproximadamente 5,3 anos, mas o processo sofre aceleração de desintegração quando é aplicado uma descarga energética de intensidade muito intensa, como acontece nas máquinas que usam o radioisótopo para terapia.
Radiação beta de baixa penetração, se dá pela desintegração do núcleo do átomo, nesse caso do cobalto 60. Essa radiação tem o poder de penetração de alguns milímetros como no caso do metal alumínio.
A radiação gama é emitida na forma de onda geralmente pelo núcleo do átomo, numa velocidade aproximadamente, a da luz, 300 000 km/s com poder de penetração bem mais profundo, é capaz de atravessar o corpo humano de um lado para outro. Somente paredes grossas de concreto, ou placas de chumbo grossas com mais ou menos 20 mm de espessura, podem deter esse tipo de radiação.
Esse isótopo é utilizado na radioterapia, no tratamento de tumores, destruindo as células cancerígenas que são muito mais susceptíveis a esse tipo de radiação, que as células normais do organismo.
Com aparelhagem que emitem a radiação do tipo beta, ou de radioterapia convencional, este serve no tratamento por exemplo, entre outros; de tumores da úvea, ou melanoma da úvea, órgão que compreende três estruturas, a íris, o corpo ciliar e coróide, regiões distintas de uma membrana ou camada vascularizada do olho, localizada na periferia intra ocular, revestindo quase totalmente o órgão, esse tumor que se desenvolve nessa região, é chamado de tumor uveal, é nesse local que pode aparecer e desenvolver o tumor maligno do olho.
Utiliza-se também em máquinas que produzem e emitem radiação gama, como por exemplo; na esterilização de alimentos industrializados e frutas. O cobalto 60 é utilizado como fonte de raios gama, contra larvas da mosca do mediterrâneo ou a Ceratitis capitata, que ataca frutas como o pêssego, laranjas, mamões, mangas alimentando das polpas, que acabam apodrecendo. O tratamento impede que as larvas se tornem adultas e sejam dessa forma, introduzidas em outras regiões infestando novas áreas.
loading...
- Lítio
Lítio - Li O lítio é o terceiro elemento químico da tabela periódica na sequência dos números atômicos. A Descoberta do...
- Hélio
O Hélio - He O hélio a nível atômico é o elemento químico número dois da tabela periódica a descoberta desse elemento químico...
- Como Se Determina A Idade De Um FÓssil
Bolsista: Roniel FranciscoOlá pessoal do QUIPIBID, nessa semana, na coluna de atualidades, vamos falar um pouco sobre uma matéria do portal G1, exibida dia 15/11/13, que relata o surgimento do cachorro doméstico na Europa, há pelo menos 19 mil anos...
- Isótopos, Isóbaros E Isótonos
Bolsista: Litton Jr.Olá amigos do QUIPIBID! Essa semana na nossa coluna de dicas de vestibular iremos falar sobre os isótonos, isóbaros e isótonos, o conteúdo é curto e de facil compreensão, mas para isso é necessário entender algumas características...
- Avaliação De Química Nº 2 - Isótopos - Isóbaros E Isótonos
1) São dados três átomos genéricos A, B e C. O átomo A tem número atômico 78 e número de massa 174. O átomo C tem 98 nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A. O número de elétrons do átomo B é: 2) São...
