Química
Ligações Intermoleculares

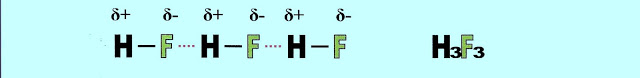
A representação do fluoreto de hidrogênio (a mesma configuração mostrada acima) ligado por pontes de hidrogênio
O fluoreto de hidrogênio ligado por pontes de hidrogênio (linha tracejada de vermelho) pode apresentar a estrutura:
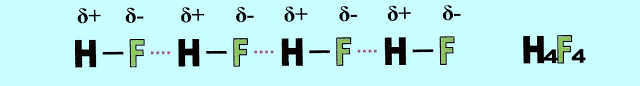
A mesma estrutura do fluoreto de hidrogênio, formada por pontes de hidrogênio (linha tracejada em vermelho) pode ser representada:
Texto em construção
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- A Electronegatividade Dos Elementos Explica Muita Coisa...
Há tempos alguém que nos lê disse-nos o seguinte: achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada. Vamos pois então falar um pouco mais de ligações de...
- Tensão Superficial Da Água
Bolsista: LoysLaynne Rodrigues Sousa Olá pessoal, hoje iremos saber um pouco mais sobre a tensão superficial da água. Sabemos que a água é muito importante para todos os seres vivos, tanto a flora quanto a...
- As ForÇas Interoleculares
Bolsista: Walmira Gomes Vocês sabem porque alguns insetos podem andar sobre a água ou como se formam as bolhas de sabão? É necessário entender o que mantém as moléculas coesas, porque elas não se separam, e o que as mantêm unidas. A resposta...
- Por Que As Colas Colam?
Bolsista: Gisléia Chaves Bom dia amigos do Quipibid! Através desta matéria, quero compartilhar com vocês esse assunto que achei muito interessante. ...
Química
Ligações Intermoleculares
Ligações Intermoleculares
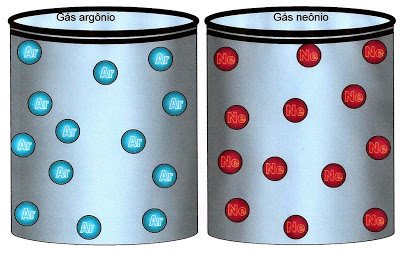
Os átomos dos gases nobres não se ligam para formarem suas substâncias. O gás argônio que produz a luz azul esverdeada é um exemplo de uma substância formada apenas por um elemento químico ou um único tipo de átomo, portanto esse gás não é formado por moléculas e sim por átomos individuais. O elemento químico que forma o gás neônio também são átomos individuais que quando excitados produzem a luz de neon de cor avermelhada.

O ponto de fusão e de ebulição dos metais são altos, o que indica que suas ligações metálicas são muito fortes. Diferentemente das ligações entre os metais, substâncias simples como o gás nitrogênio, gás hidrogênio, gás oxigênio, as substâncias compostas como a água, álcool, sacarose, gasolina e muitas outras, formadas por ligações covalentes, possuem a característica de interações entre as suas moléculas. Essa interações é que fazem com que essas substâncias se aglomerem e se tornem visíveis aos nossos olhos.
Outra característica dessas substâncias que se aglomeram por interações intermoleculares é que são ligações fracas, por esse motivo essas substâncias possuem o ponto de fusão e ebulição geralmente baixos, pois; as ligações intermoleculares se rompem com facilidade.
Um bom exemplo de interação intermolecular de intensidade fraca acontece com a substância sacarose C12H22O11 (açúcar), que é indicado pela sua baixa temperatura de fusão.
Gás carbônico (CO2), gás cloro Cl2, gás metano (CH4), possuem interações intermoleculares extremamente fracas, pois mesmo em temperaturas muito baixas estão no estado gasoso. Respectivamente os seus pontos de fusão são: -56,57 ºC, -102 ºC, -90,5 ºC.
Substância Polar e a Ligação Intermolecular
Ligações Dipolo-dipolo
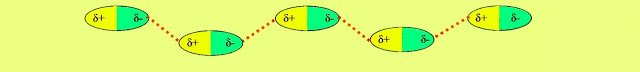
Pode acontecer com a substância ácido clorídrico (HCl) que possui dipolo elétrico bem caracterizado, a parte eletropositiva da molécula representada pela letra grega delta minúsculo positivo e a parte eletronegativa pela letra grega delta minúsculo negativo.

São ligações que ocorrem na molécula polar com outra molécula polar. Observe que as moléculas possuem nas extremidades cargas opostas, de um lado eletronegativa, e do outro eletropositiva, que atrai outra molécula por seu polo de carga oposta e assim por diante. Essas ligações são relativamente duráveis.

Conforme os critérios de arranjo intermolecular, as ligações dipolo-dipolo também pode se apresentar conforme o esquema a seguir.
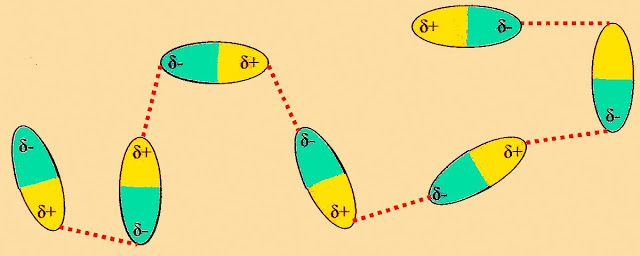

Segundo pesquisadores, as ligações dipolo-dipolo também pode se arranjar conforme a seguinte estrutura visualizada na figura a seguir.

Ligação Por Pontes de Hidrogênio
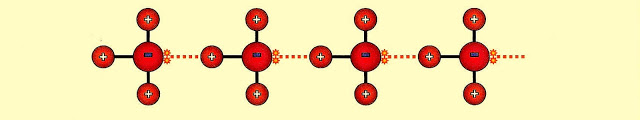
Gás fluorídrico
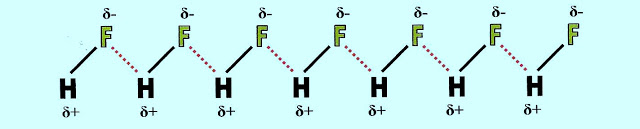
As ligações intermoleculares do fluoreto de hidrogênio (HF) cuja diferença de eletronegatividade dos componentes da molécula é de 1,8, são do tipo, ligação de hidrogênio.

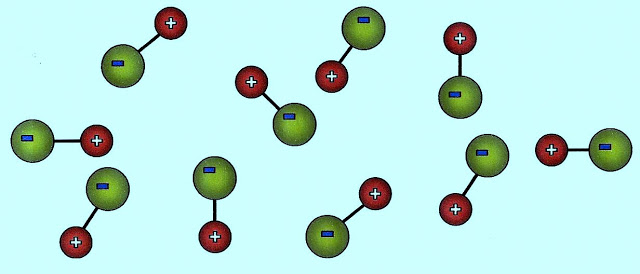
A formação das pontes de hidrogênio. O gás fluorídrico forma a seguinte configuração.
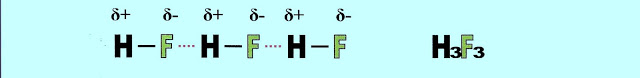

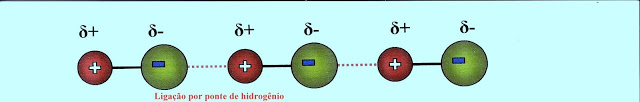
O fluoreto de hidrogênio ligado por pontes de hidrogênio (linha tracejada de vermelho) pode apresentar a estrutura:
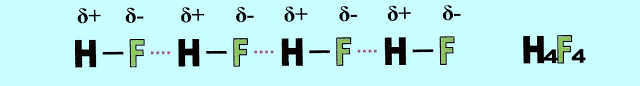

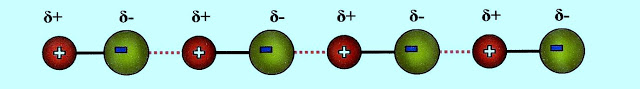
O mesmo fluoreto de hidrogênio ligado por pontes de hidrogênio, na forma líquida, se apresenta segundo o esquema simplificado.

Pontes de Hidrogênio Nas Moléculas da Água
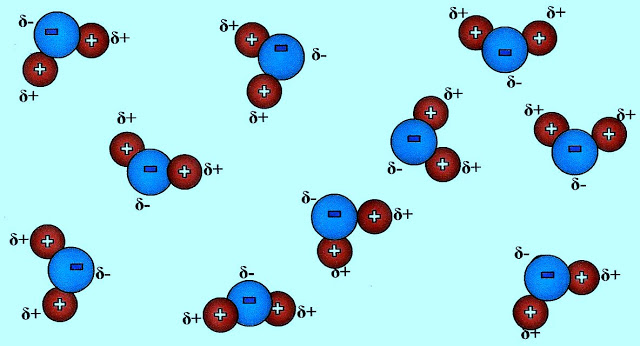
Água na forma gasosa
As moléculas da água estão separadas, mesmo com a polaridade de suas moléculas, o intenso movimento de suas partículas não permite a ligação intermolecular entre elas.

Pontes de Hidrogênio e a Água no Estado Líquido
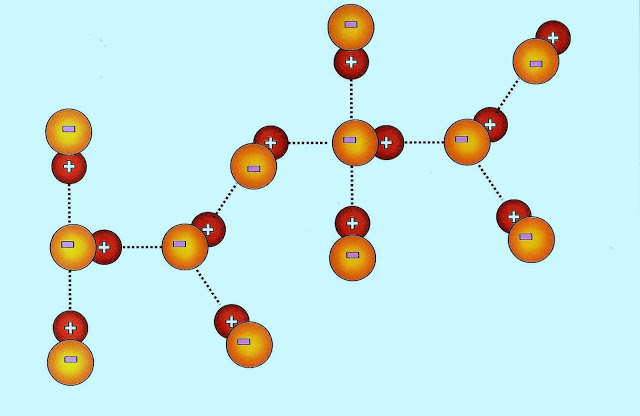
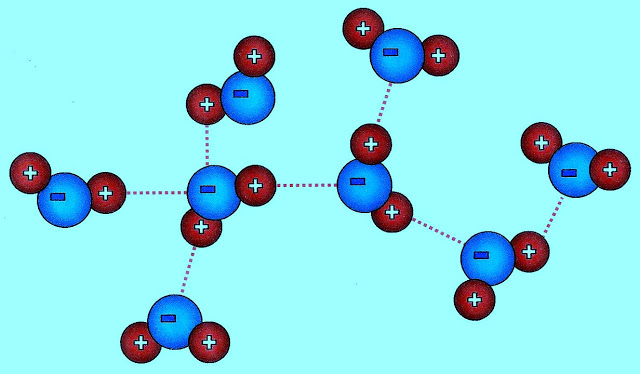
Conforme os pesquisadores apresentam suas fórmulas, uma molécula de água pode formar até 4 ligações por pontes de hidrogênio (tracejado em vermelho), através de suas atrações eletropositiva e eletronegativa, com outras moléculas iguais.

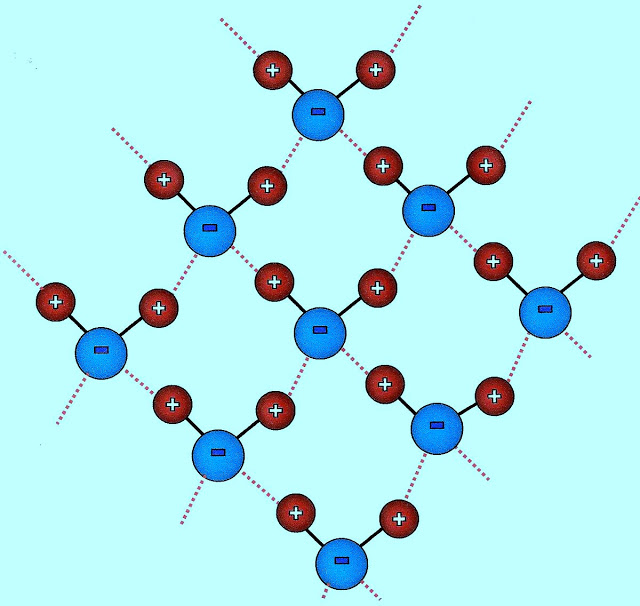
Conforme outro modelo de esquematização encontrado, as ligações intermoleculares entre as moléculas de água apresentadas (linhas tracejadas em vermelho), essas partículas se juntam formando pontes de hidrogênio semelhante a configuração abaixo.

Pontes de Hidrogênio e a Tensão Superficial da Água.
Você já observou num dia calmo a superfície da água de um lago, insetos caminhando tranquilamente sobre a sua superfície sem afundar? É que na superfície da água, ocorre o fenômeno de tensão superficial. Essa tensão superficial se dá pelo fato das moléculas de água se atraírem e se juntarem pelas ligações eletroestáticas, ou pontes de hidrogênio. Portanto para as moléculas de água abaixo da superfície que estão cercadas, uma pelas outras, pela atração das suas cargas positivas e negativas, ocorre a ligação por pontes de hidrogênio normalmente. No entanto as moléculas da superfície, são unidas apenas pelas partes voltadas para o interior do líquido, ou seja; contato uma com as outras, pelos seus lados e sua parte inferior. A parte de cima, na superfície, não ocorre contato com outras moléculas, portanto, ao interagirem se interligam e se unem muito mais firmemente, criando a tensão superficial.
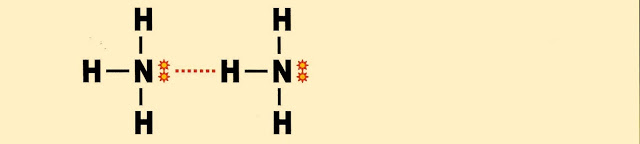
Pontes de Hidrogênio e Formação da Amônia Líquida
A amônia tem o ponto de fusão a -77 ºC e entra em ebulição a temperatura de -33 ºC. A parte eletronegativa de uma molécula pode se combinar com a parte positiva de outra e formar ponte de hidrogênio (tracejado em vermelho) entre suas moléculas na sua liquefação.
Observe a disposição:
Observe a disposição:

Com base no esquema anterior podemos dispor a sequência das moléculas da amônia ligadas formando a estrutura.

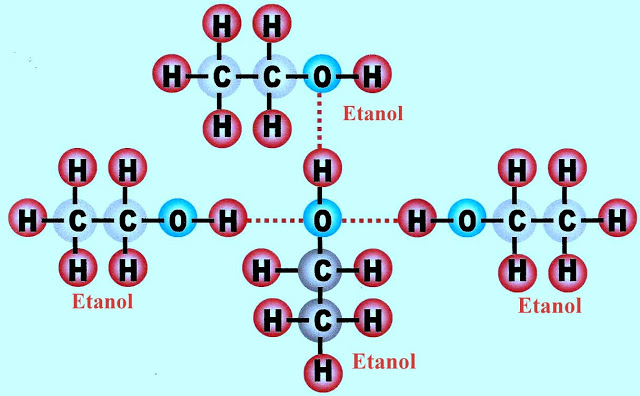
Pontes de Hidrogênio no Etanol
O álcool etanol forma pontes de hidrogênio entre o grupo hidroxila (OH-) de suas moléculas.
O álcool etanol forma pontes de hidrogênio entre o grupo hidroxila (OH-) de suas moléculas.

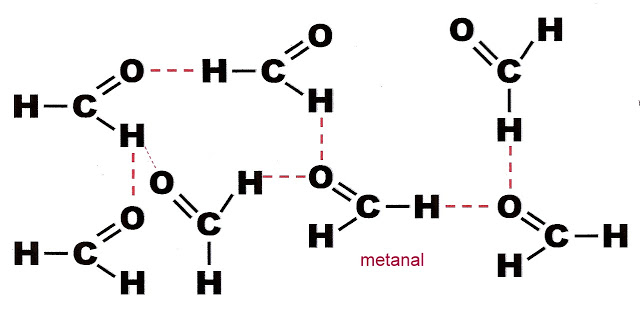
Ligação intermolecular do metanal
Esse tipo de ligação é polar e é feito por pontes de hidrogênio, ou por hidrogênio propriamente dito.

Texto em construção
loading...
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- A Electronegatividade Dos Elementos Explica Muita Coisa...
Há tempos alguém que nos lê disse-nos o seguinte: achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada. Vamos pois então falar um pouco mais de ligações de...
- Tensão Superficial Da Água
Bolsista: LoysLaynne Rodrigues Sousa Olá pessoal, hoje iremos saber um pouco mais sobre a tensão superficial da água. Sabemos que a água é muito importante para todos os seres vivos, tanto a flora quanto a...
- As ForÇas Interoleculares
Bolsista: Walmira Gomes Vocês sabem porque alguns insetos podem andar sobre a água ou como se formam as bolhas de sabão? É necessário entender o que mantém as moléculas coesas, porque elas não se separam, e o que as mantêm unidas. A resposta...
- Por Que As Colas Colam?
Bolsista: Gisléia Chaves Bom dia amigos do Quipibid! Através desta matéria, quero compartilhar com vocês esse assunto que achei muito interessante. ...
