Química
Metais
Metais - Definição
- Ligas Metálicas
Ligas Metálicas Ligas Metálicas - Definição Nas Ligas metálicas deve haver dois ou mais componentes e pelo menos um componente é o principal. As...
- Cálculo Das Porcentagens Dos Elementos Químicos
Cálculo Das Porcentagens Dos Elementos Químicos Calcular as porcentagens dos elementos químicos presentes em uma fórmula molecular representativa de uma substância, é conhecer o quanto esses elementos são necessários na composição da substância. ...
- Eletrólise
Eletrólise Eletrólise A eletrólise de um modo geral é caracterizada por ser um processo de oxirredução ou de obtenção de íons livres com...
- LigaÇÃo Metalica
Bolsistas:Andressa G. e Loys L. Tudo bem galerinha do Quipibid??!!! Hoje iremos aprender um pouco de ligação metálica. Como sabemos os metais são ótimos condutores de eletricidade e calor. Muitos são maleáveis e dúcteis. Essas propriedades estão...
- Processo Industrial Do Ferro (fe)
Bolsista: Ana Lucia Miranda Olá leitores, nesta matéria iremos falar da produção industrial do ferro, que exerce um importantíssimo papel na economia de um país. Em nossas vidas, a siderurgia...
Química
Metais
Metais
Metais - Definição
Os metais são sólidos, (com exceção do mercúrio) são bons condutores de eletricidade, conduzem também calor, a estrutura do arranjo dos átomos dos metais é a cristalina, no seu estado de pureza possuem até brilho, quando são polidos apresentam essa característica. Possuem, maleabilidade, ductilidade, condutibilidade, os pontos de fusão e ebulição são altos.
Dureza Dos Metais
Um dos processos de purificação da prata é feito por ustulação, ou seja processo pelo qual os sulfetos de prata são queimados para se obter a prata pura. A prata também no seu último estágio é obtida pura por refinamento eletrolítico, ou processo eletrolítico.
Ferro (Fe)
A massa atômica do ferro é de aproximadamente 56 u ou 56 gramas por mol, a sua densidade é 7,87 g/cm3, o ponto de fusão é de 1538 ºC e o ponto de ebulição é de 2861 ºC
O ferro na forma de metal é obtido industrialmente por processos siderúrgicos em alto forno.
Por injeção de pós com o uso da metalurgia do pó convencional ou ainda por processos de eletrodo rotatório à plasma.
Texto em construção.
Dureza Dos Metais
Elemento químico | Símbolo | Dureza |
Sódio | Na | 0,4 |
Estanho | Sn | 2,0 |
Cálcio | Ca | 2,5 |
Chumbo | Pb | 2,5 |
Ouro | Au | 3,0 |
Níquel | Ni | 4,5 |
Ferro | Fe | 4,5 |
Irídio | Ir | 6,5 |
Ósmio | Os | 7,0 |
Tungstênio | W | 7,0 |
Crômio | Cr | 8,9 |
Conformação Dos Metais
Define-se conformação dos metais o forjamento, laminação, extrusão, estiramento, estampagem.
Forjamento
Em primeiro lugar para que haja o forjamento do metal este deve ser ductil, ou maleável ou ainda, ter a qualidade que possa ser batido (martelado a frio ou quente, numa bigorna) que possa ser distendido ou comprimido,(Prensado), dobrado, achatado ou transformado em chapas por enorme pressão, sem que haja o rompimento do metal.
A forja consiste em colocar o metal que foi aquecido numa fornalha e ainda no estado incandescente sobre uma bigorna, martelar e modelar.
Ustulação
Para Minérios de Metais Nobres
Os minerais considerados como nobres são, o ouro, a prata, o cobre e o mercúrio. A ustulação para esses tipos de minérios se faz pelo seu aquecimento com a presença de gás oxigênio,que libera como produto final, geralmente o sulfeto e o metal desejado já reduzido.
Exemplo a ustulação da argentita (Ag2S) mineral do qual se obtém a prata.
Ag2S + O2 ----- ? ----- 2 Ag + SO2
A Ustulação Para os Minérios de Metais Não Nobres
A ustulação para esses tipos de minérios, consiste na aquecimento ou queima do sulfeto de um mineral na presença de O2 para a formação de óxido.
Exemplo o sulfeto de zinco (ZnS) pela ustulação se transforma em óxido que depois é purificado pelo processo de redução.
Exemplos de MetaisForjamento
Em primeiro lugar para que haja o forjamento do metal este deve ser ductil, ou maleável ou ainda, ter a qualidade que possa ser batido (martelado a frio ou quente, numa bigorna) que possa ser distendido ou comprimido,(Prensado), dobrado, achatado ou transformado em chapas por enorme pressão, sem que haja o rompimento do metal.
A forja consiste em colocar o metal que foi aquecido numa fornalha e ainda no estado incandescente sobre uma bigorna, martelar e modelar.
Ustulação
Para Minérios de Metais Nobres
Os minerais considerados como nobres são, o ouro, a prata, o cobre e o mercúrio. A ustulação para esses tipos de minérios se faz pelo seu aquecimento com a presença de gás oxigênio,que libera como produto final, geralmente o sulfeto e o metal desejado já reduzido.
Exemplo a ustulação da argentita (Ag2S) mineral do qual se obtém a prata.
Ag2S + O2 ----- ? ----- 2 Ag + SO2
A Ustulação Para os Minérios de Metais Não Nobres
A ustulação para esses tipos de minérios, consiste na aquecimento ou queima do sulfeto de um mineral na presença de O2 para a formação de óxido.
Exemplo o sulfeto de zinco (ZnS) pela ustulação se transforma em óxido que depois é purificado pelo processo de redução.
Ouro (Au)
A massa atômica do ouro é 197 u ou 197 gramas por mol, densidade 19,32 g/cm3, ponto de fusão a 1064ºC e ponto de ebulição 2970 ºC.
A massa atômica do ouro é 197 u ou 197 gramas por mol, densidade 19,32 g/cm3, ponto de fusão a 1064ºC e ponto de ebulição 2970 ºC.
Um dos processos de purificação do ouro é feito por ustulação, ou seja processo pelo qual os seus sulfetos são queimados para se obter o ouro puro.
Prata (Ag)
A massa atômica da prata é aproximadamente 108 u ou 108 gramas por mol, densidade é 10,49 g/cm3, ponto de fusão de 961,8 ºC e ponto de ebulição é de 2162 ºC.
A massa atômica da prata é aproximadamente 108 u ou 108 gramas por mol, densidade é 10,49 g/cm3, ponto de fusão de 961,8 ºC e ponto de ebulição é de 2162 ºC.
Um dos processos de purificação da prata é feito por ustulação, ou seja processo pelo qual os sulfetos de prata são queimados para se obter a prata pura. A prata também no seu último estágio é obtida pura por refinamento eletrolítico, ou processo eletrolítico.
Ferro (Fe)
A massa atômica do ferro é de aproximadamente 56 u ou 56 gramas por mol, a sua densidade é 7,87 g/cm3, o ponto de fusão é de 1538 ºC e o ponto de ebulição é de 2861 ºC
O ferro na forma de metal é obtido industrialmente por processos siderúrgicos em alto forno.
Cobre (Cu)
Há diferentes processos de obtenção, Quando o mineral de cobre é formado por sulfeto, o processo é feito por ustulação. O processo final da produção do cobre na forma de metal puro é por processo eletrolítico.
Alumínio (Al)
Zinco (Zn)
A massa do zinco é aproximadamente 65 u ou 65 gramas por mol, a sua densidade é 7,14 g/cm3, o seu ponto de fusão é de 419 ºC e o seu ponto de ebulição é de 907 ºC.
O metal de zinco purificado é obtido por eletrólise
Antimônio (Sb)
A massa do antimônio é 121,7 u ou 121,7 gramas por mol, a sua densidade é de 6,697 g/cm3 , o seu ponto de fusão é de 630 ºC, e o seu ponto de ebulição é de 1587 ºC, a dureza do material é 3.
O metal puro é obtido por eletrólise.
Nióbio (Nb)
A massa do nióbio é aproximadamente 93, o seu ponto de fusão é 2477 ºC, e o seu ponto de ebulição é 4744 ºC, a dureza do material é 6.0.
O metal purificado é obtido por eletrólise.
Há diferentes processos de obtenção, Quando o mineral de cobre é formado por sulfeto, o processo é feito por ustulação. O processo final da produção do cobre na forma de metal puro é por processo eletrolítico.
Alumínio (Al)
A massa do alumínio é 27 u ou 27 gramas por mol, a sua densidade é 2,75 gramas por cm3, o seu ponto de fusão é de 660 ºC, e o ponto de ebulição é de 2519 ºC.
A parte final de sua obtenção como metal purificado é feita por eletrólise.Zinco (Zn)
A massa do zinco é aproximadamente 65 u ou 65 gramas por mol, a sua densidade é 7,14 g/cm3, o seu ponto de fusão é de 419 ºC e o seu ponto de ebulição é de 907 ºC.
O metal de zinco purificado é obtido por eletrólise
Antimônio (Sb)
A massa do antimônio é 121,7 u ou 121,7 gramas por mol, a sua densidade é de 6,697 g/cm3 , o seu ponto de fusão é de 630 ºC, e o seu ponto de ebulição é de 1587 ºC, a dureza do material é 3.
O metal puro é obtido por eletrólise.
Nióbio (Nb)
A massa do nióbio é aproximadamente 93, o seu ponto de fusão é 2477 ºC, e o seu ponto de ebulição é 4744 ºC, a dureza do material é 6.0.
O metal purificado é obtido por eletrólise.
Titânio (Ti)
Por injeção de pós com o uso da metalurgia do pó convencional ou ainda por processos de eletrodo rotatório à plasma.
Tungstênio (W)
No Brasil no Estado do Rio grande do Norte o tungstênio é encontrado. Obtido a partir do mineral scheelita (CaWO4) ou da wolframita (Fe,Mn)WO4
No Brasil no Estado do Rio grande do Norte o tungstênio é encontrado. Obtido a partir do mineral scheelita (CaWO4) ou da wolframita (Fe,Mn)WO4
Molibdênio (Mo)
O molibdênio é obtido do mineral molibdenita (sulfeto de molibdênio), principal minério de obtenção industrial que feito por redução do trióxido de molibdato (MoO3).
Cromo (Cr)
A massa do cromo ou crômio é 24 U ou 24 gramas por mol, a sua densidade é 7,2g/cm3, o ponto de fusão é de 1907 ºC e o ponto de ebulição é de 2671ºC. O cromo é obtido pelo processo de redução em aquecimento.
Manganês (Mn)
O metal puro de manganês é obtido no último estágio da preparação, que é feita por eletrólise e pós eletrólise.
Presença Dos Minerais Na Superfície Terrestre.
Oxido de Cromo III (Cr2O3)
O mineral óxido de cromo III não é encontrado em grandes proporções, está presente com 0,012 % da massa da crosta terrestre.
Óxido de Manganês ou Pirolusita
O mineral óxido de manganês ou pirolusita é encontrado relativamente em grandes proporções, está presente com 0,11 % da massa da crosta terrestre.
Pentlandita (FeS.NiS)
A pentlandita é o principal minério utilizado na obtenção do níquel metálico, os minerais dos quais se obtém o níquel são relativamente raros com uma proporção de 0,01% da massa da superfície terrestre.
Obtenção dos Metais
Siderurgia
O molibdênio é obtido do mineral molibdenita (sulfeto de molibdênio), principal minério de obtenção industrial que feito por redução do trióxido de molibdato (MoO3).
Cromo (Cr)
A massa do cromo ou crômio é 24 U ou 24 gramas por mol, a sua densidade é 7,2g/cm3, o ponto de fusão é de 1907 ºC e o ponto de ebulição é de 2671ºC. O cromo é obtido pelo processo de redução em aquecimento.
Manganês (Mn)
O metal puro de manganês é obtido no último estágio da preparação, que é feita por eletrólise e pós eletrólise.
Presença Dos Minerais Na Superfície Terrestre.
Oxido de Cromo III (Cr2O3)
O mineral óxido de cromo III não é encontrado em grandes proporções, está presente com 0,012 % da massa da crosta terrestre.
Óxido de Manganês ou Pirolusita
O mineral óxido de manganês ou pirolusita é encontrado relativamente em grandes proporções, está presente com 0,11 % da massa da crosta terrestre.
Pentlandita (FeS.NiS)
A pentlandita é o principal minério utilizado na obtenção do níquel metálico, os minerais dos quais se obtém o níquel são relativamente raros com uma proporção de 0,01% da massa da superfície terrestre.
Obtenção dos Metais
Siderurgia
Obtenção do Ferro
O ferro é obtido por processo siderúrgico em altos-fornos. O alto-forno tem o sentido literal da palavra devido a altura chegando de 30 até 40 metros de altura com 10 metros de diâmetro. Há altos-fornos de tamanho menores utilizados na indústria de metalurgia.
O processo de produção do ferro metálico se dá da seguinte forma. Num alto forno é despejado carvão coque misturado com o minério de ferro (Fe2O3) e calcário (CaCO3). Na parte superior do alto-forno, com a temperatura de aproximadamente 700 ºC o mineral começa a sua fusão e a liberação de CO2, nesse local começa a purificação do ferro. Em seguida na parte mais abaixo, com a temperatura por volta de 1000ºC o calcário despejado reaje, produz óxido de cálcio (CaO) e parte do monóxido de carbono que é utilizado. O CaO se mistura e interage com os compostos de silicatos, formando por exemplo, o CaSiO3 ou o CaAl2O4 e com outras impurezas retiradas do minério de ferro separando-os.
Ao mesmo tempo, ao entrar em combustão, o carvão coque, produz o monóxido de carbono (CO) e o mineral de ferro completa a sua fusão, na zona de 1600 ºC, o monóxido de carbono se une ao ferro e o reduz e em seguida sai como CO2. Nessa parte é injetado ar em alta pressão, que favorece a queima do restante de carbono e ajuda a retirar o seu excesso que também sai na forma de CO2. Nessa fase o ferro vai se tornando cada vez mais reduzido pela ação do carbono agregado e devido ao peso do metal e da gravidade, desce, nesse ponto o minério de ferro metálico já completamente reduzido vai se acumulando no fundo do alto forno, e o calcário que sofreu decomposição, produz o óxido de cálcio (CaO), que interage com as impurezas separadas do minério derretido, por ser mais leve, e flutua sobre o ferro metálico derretido.
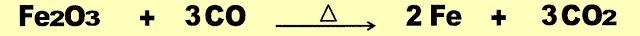
Obtenção do Cromo
Reação do Óxido de Cromo III Com Carbono
O minério óxido de cromo (Cr2O3) reage com carbono (C) que é o redutor sob aquecimento, produzindo o cromo metálico e monóxido de carbono.
Observe a reação.

Outro modo de obtenção do cromo é através do alumínio chamado de aluminotermia. A técnica é realizada segundo a reação: o minério óxido de cromo III reage com alumínio metálico que é o redutor, a quente, produzindo cromo metálico e óxido de alumínio.
A reação pode ser observada a seguir.

Obtenção do Alumínio
Método de Héroult & Hall
O método consiste na eletrólise da alumina (Al2O3) dissolvido em criolita (Na3AlF3) em ponto de fusão a 1000 ºC, tendo como eletrodo de carbono grafite. O ânodo libera gás oxigênio da alumina que vai para o eletrodo de carvão reagindo com o carbono se transforma em CO2 que é liberado.
Obtenção de Estanho
O mineral cassiterita reage com carbono o redutor e sofre redução em temperatura de fusão, produzindo estanho metálico e monóxido de carbono.
A reação é esquematizada abaixo.

Obtenção de Chumbo
Ustulação
A primeira etapa é feita pelo processo de ustulação, o minério galena reage sob aquecimento com oxigênio e produz óxido de chumbo II.
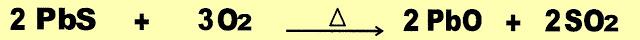
Redução Pelo Carbono
A segunda etapa é da redução do óxido de chumbo II pelo carbono, que reage sob aquecimento produzindo o chumbo metálico e monóxido de carbono.
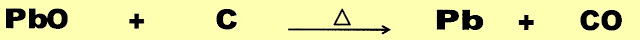
Obtenção do Zinco do Mineral Blenda
Ustulação
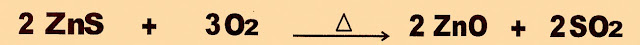
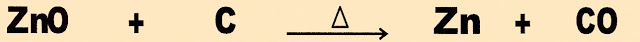
Obtenção da Prata
Ustulação
Esse processo se resume do seguinte modo: o mineral da prata, a argentita, reage com oxigênio em alta temperatura e forma a prata metálica mais anidrido sulfúrico, ou dióxido de enxofre.

Obtenção do Mercúrio
Ustulação do Cinábrio
O mineral cinábrio na presença de oxigênio, reage ao aquecimento, e produz o mercúrio metálico e anidrido sulfúrico.

Obtenção do Cobre
Processo Eletrolítico
O cobre obtido pelo processo de metalurgia possui uma pureza de 98 %, para ser utilizado como condutor elétrico necessita ser purificado ainda mais para evitar a resistência elétrica.
Processo Técnico
Num recipiente chamado de cuba eletrolítica coloca-se solução aquosa de sulfato de cobre CuSO4 que se dissocia e forma SO42- e Cu2+.
Na solução deverá passar uma corrente elétrica que será ligada a um ânodo polo positivo ( + ) e a um cátodo, polo negativo ( - ).
O ânodo deverá ser de cobre, uma placa de cobre por exemplo. A solução de sulfato de cobre, de pureza 98 % também serve como ânodo.
O cátodo poderá ser uma placa de aço inoxidável.
Para o ânodo, placa de cobre, o cobre oxidado (Cu²+) da solução, ainda impuro, migra.
Do mesmo modo, outros metais como ouro (Au), prata (Ag), platina (Pt) ferro (Fe), zinco (Zn) presentes na solução, também migram para esse ânodo e se juntam ao cobre impuro.
Com a atuação da corrente elétrica o cátodo com a carga positiva, começa atrair o cobre do ânodo e esse cobre que está oxidado como Cu²+, recebe 2 elétrons e se torna reduzido Cuº e se fixa no cátodo ou placa de aço inox. É o cobre já purificado.
Os outros metais nobres como ouro, prata, níquel, que estavam junto com o cobre oxidado do ânodo, não oxidam e descem para o fundo da cuba eletrolítica formando a lama anódica.
Os metais não nobres como o ferro zinco níquel se oxidam no ânodo, mas não conseguem se reduzir no cátodo e permanecem na solução.
A lama anódica, posteriormente poderá ser aproveitada pela extração ou venda dos materiais como o Au, Ag, Pt, sílica, e restos de outros minérios presentes.
Uso Dos Metais
O Uso do Ferro
O ferro é utilizado na construção civil, na forma de vergalhões no concreto armado, na fabricação de trituradeiras, trilhos de trens, tem seu emprego na forma das ligas de aço formada com níquel e cromo, que se presta às confecções de ferramentas como tesouras, martelos, facas, arames, chapas, motores, é utilizado na formação de ligas como o latão, e ainda de outros diferentes tipos de aços, como o aço inox para pias de cozinha, e utensílios como chaleiras, bules, panelas. Tem seu emprego na industria automobilística, naval e aeronáutica. É ainda utilizado como corante na forma de óxidos que apresentam cores amarela, vermelha, marrom, azul etc.
O Ferro Nos Organismos Vivos
O ferro está presente no núcleo pirrólico da hemoglobina do glóbulo vermelho sanguíneo e é o responsável pelo transporte do oxigênio no sangue, o sulfato ferroso é utilizado como suplemento nutricional, é utilizado na preparação de meios de cultura para bactérias em laboratório. O ferro ainda faz parte da constituição dos citocromos que são proteínas de membranas de organelas internas de células eucariontes como as membranas das mitocôndrias e do retículo endoplasmático, está presente na ferrodoxina e em enzimas como as catalases e as peroxidases. Ainda tem seu emprego na estruturação dos cloroplastos das plantas.
O Ferro Nos Alimentos
O ferro também está presente em muitos alimentos como as carnes em geral e peixes, na gema de ovo, em pães de cevada e de soja, nas ervilhas e lentilhas, feijão branco, beterraba, agrião e muitos outros.
Os vegetais utilizam o ferro na síntese da clorofila.
O acúmulo de ferro no organismo pode levar a toxicidade. Sem ferro no organismo, este fica sujeito a anemias, porém em excesso pode causar a deposição do ferro nas células do fígado, ou no baço, na medula óssea, miocárdio e glândulas endócrinas em geral, levando a destruição celular local, fibrose e insuficiência do órgão.
Uso do Ouro
O ouro é utilizado como moeda de troca pelo povo antigo até nossos dias num período de 5000 anos, atualmente é utilizado como reserva monetária. Na joalheria, é utilizado na produção de ligas de prata e cobre na confecções de jóias. Na gastronomia é utilizado na decoração de doces e bolos, em microscopia é utilizado no revestimento de material biológico, o que permite a visualização através de microscopia eletrônica de varredura. Em eletrônica é também empregado na tecnologia de satélites artificiais, aplicado em placas de computadores, celulares, tela de televisão, câmeras fotográficas, também em revestimentos de vidros de janelas de edifícios para refletir a radiação infra vermelha impedindo a sua penetração nos ambientes.
O ouro também é utilizado industrialmente como catalisador acelerador de reações, na medicina nas aplicações terapêuticas do câncer (quimioterapia), no reumatismo na Aids, malária, problemas de pele e nas cirurgias, como malhas na restauração de vasos sanguíneos.
Cálculos
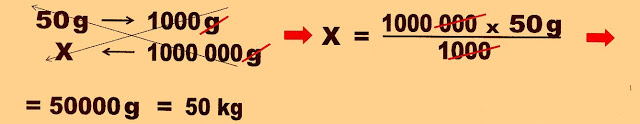
1) Sabendo que para ser produzido um quilograma de alumínio metálico puro, necessita-se em média de 2 quilogramas de alumina (Al2O3) que é obtida a partir de 4 ou 5 quilogramas de bauxita e 50 gramas de criolita (Na3AlF3). Com esse conhecimento pergunta-se: para se produzir uma tonelada de alumínio, quantos quilogramas de criolita são necessários?
Assinale a alternativa correta.
a) 0,5 kg b) 500 g c) 5,0 kg d) 5000 g e) 50 kg
Resolução
Exercícios
1) Assinale apenas a correta. Podemos definir os metais como sendo:
a) bons condutores de sons, de ondas, a estrutura atômica dos metais é compacta, possuem instabilidade, são duráveis quando expostos as intempéries sem proteção.
O processo de produção do ferro metálico se dá da seguinte forma. Num alto forno é despejado carvão coque misturado com o minério de ferro (Fe2O3) e calcário (CaCO3). Na parte superior do alto-forno, com a temperatura de aproximadamente 700 ºC o mineral começa a sua fusão e a liberação de CO2, nesse local começa a purificação do ferro. Em seguida na parte mais abaixo, com a temperatura por volta de 1000ºC o calcário despejado reaje, produz óxido de cálcio (CaO) e parte do monóxido de carbono que é utilizado. O CaO se mistura e interage com os compostos de silicatos, formando por exemplo, o CaSiO3 ou o CaAl2O4 e com outras impurezas retiradas do minério de ferro separando-os.
Ao mesmo tempo, ao entrar em combustão, o carvão coque, produz o monóxido de carbono (CO) e o mineral de ferro completa a sua fusão, na zona de 1600 ºC, o monóxido de carbono se une ao ferro e o reduz e em seguida sai como CO2. Nessa parte é injetado ar em alta pressão, que favorece a queima do restante de carbono e ajuda a retirar o seu excesso que também sai na forma de CO2. Nessa fase o ferro vai se tornando cada vez mais reduzido pela ação do carbono agregado e devido ao peso do metal e da gravidade, desce, nesse ponto o minério de ferro metálico já completamente reduzido vai se acumulando no fundo do alto forno, e o calcário que sofreu decomposição, produz o óxido de cálcio (CaO), que interage com as impurezas separadas do minério derretido, por ser mais leve, e flutua sobre o ferro metálico derretido.
A reação da hematita com monóxido de carbono e a produção de ferro metálico.
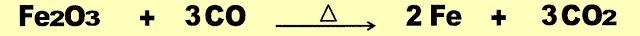
Reação do Óxido de Cromo III Com Carbono
O minério óxido de cromo (Cr2O3) reage com carbono (C) que é o redutor sob aquecimento, produzindo o cromo metálico e monóxido de carbono.
Observe a reação.

Reação do Óxido de Cromo III Com Alumínio Metálico
Aluminotermia
Aluminotermia
Outro modo de obtenção do cromo é através do alumínio chamado de aluminotermia. A técnica é realizada segundo a reação: o minério óxido de cromo III reage com alumínio metálico que é o redutor, a quente, produzindo cromo metálico e óxido de alumínio.
A reação pode ser observada a seguir.

Obtenção do Alumínio
Método de Héroult & Hall
O método consiste na eletrólise da alumina (Al2O3) dissolvido em criolita (Na3AlF3) em ponto de fusão a 1000 ºC, tendo como eletrodo de carbono grafite. O ânodo libera gás oxigênio da alumina que vai para o eletrodo de carvão reagindo com o carbono se transforma em CO2 que é liberado.
Obtenção de Estanho
O mineral cassiterita reage com carbono o redutor e sofre redução em temperatura de fusão, produzindo estanho metálico e monóxido de carbono.
A reação é esquematizada abaixo.

Obtenção de Chumbo
Ustulação
A primeira etapa é feita pelo processo de ustulação, o minério galena reage sob aquecimento com oxigênio e produz óxido de chumbo II.
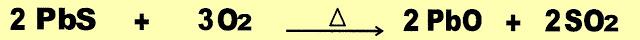
Redução Pelo Carbono
A segunda etapa é da redução do óxido de chumbo II pelo carbono, que reage sob aquecimento produzindo o chumbo metálico e monóxido de carbono.
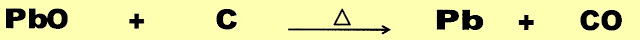
Obtenção do Zinco do Mineral Blenda
Ustulação
O primeiro processo de preparação é a reação de ustulação do minério blenda com oxigênio em alta temperatura para produzir o zinco metálico .
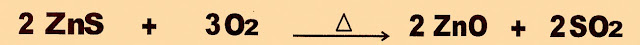
Redução do óxido de zinco
Numa segunda etapa o óxido de zinco formado, reage com carbono que é o redutor, em alta temperatura e produz o zinco metálico e monóxido de carbono.
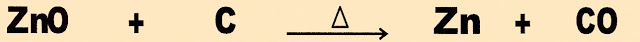
Obtenção da Prata
Ustulação
Esse processo se resume do seguinte modo: o mineral da prata, a argentita, reage com oxigênio em alta temperatura e forma a prata metálica mais anidrido sulfúrico, ou dióxido de enxofre.

Obtenção do Mercúrio
Ustulação do Cinábrio
O mineral cinábrio na presença de oxigênio, reage ao aquecimento, e produz o mercúrio metálico e anidrido sulfúrico.

Obtenção do Cobre
Processo Eletrolítico
O cobre obtido pelo processo de metalurgia possui uma pureza de 98 %, para ser utilizado como condutor elétrico necessita ser purificado ainda mais para evitar a resistência elétrica.
Processo Técnico
Num recipiente chamado de cuba eletrolítica coloca-se solução aquosa de sulfato de cobre CuSO4 que se dissocia e forma SO42- e Cu2+.
Na solução deverá passar uma corrente elétrica que será ligada a um ânodo polo positivo ( + ) e a um cátodo, polo negativo ( - ).
O ânodo deverá ser de cobre, uma placa de cobre por exemplo. A solução de sulfato de cobre, de pureza 98 % também serve como ânodo.
O cátodo poderá ser uma placa de aço inoxidável.
Para o ânodo, placa de cobre, o cobre oxidado (Cu²+) da solução, ainda impuro, migra.
Do mesmo modo, outros metais como ouro (Au), prata (Ag), platina (Pt) ferro (Fe), zinco (Zn) presentes na solução, também migram para esse ânodo e se juntam ao cobre impuro.
Com a atuação da corrente elétrica o cátodo com a carga positiva, começa atrair o cobre do ânodo e esse cobre que está oxidado como Cu²+, recebe 2 elétrons e se torna reduzido Cuº e se fixa no cátodo ou placa de aço inox. É o cobre já purificado.
Os outros metais nobres como ouro, prata, níquel, que estavam junto com o cobre oxidado do ânodo, não oxidam e descem para o fundo da cuba eletrolítica formando a lama anódica.
Os metais não nobres como o ferro zinco níquel se oxidam no ânodo, mas não conseguem se reduzir no cátodo e permanecem na solução.
A lama anódica, posteriormente poderá ser aproveitada pela extração ou venda dos materiais como o Au, Ag, Pt, sílica, e restos de outros minérios presentes.
O Uso do Ferro
O ferro é utilizado na construção civil, na forma de vergalhões no concreto armado, na fabricação de trituradeiras, trilhos de trens, tem seu emprego na forma das ligas de aço formada com níquel e cromo, que se presta às confecções de ferramentas como tesouras, martelos, facas, arames, chapas, motores, é utilizado na formação de ligas como o latão, e ainda de outros diferentes tipos de aços, como o aço inox para pias de cozinha, e utensílios como chaleiras, bules, panelas. Tem seu emprego na industria automobilística, naval e aeronáutica. É ainda utilizado como corante na forma de óxidos que apresentam cores amarela, vermelha, marrom, azul etc.
O Ferro Nos Organismos Vivos
O ferro está presente no núcleo pirrólico da hemoglobina do glóbulo vermelho sanguíneo e é o responsável pelo transporte do oxigênio no sangue, o sulfato ferroso é utilizado como suplemento nutricional, é utilizado na preparação de meios de cultura para bactérias em laboratório. O ferro ainda faz parte da constituição dos citocromos que são proteínas de membranas de organelas internas de células eucariontes como as membranas das mitocôndrias e do retículo endoplasmático, está presente na ferrodoxina e em enzimas como as catalases e as peroxidases. Ainda tem seu emprego na estruturação dos cloroplastos das plantas.
O Ferro Nos Alimentos
O ferro também está presente em muitos alimentos como as carnes em geral e peixes, na gema de ovo, em pães de cevada e de soja, nas ervilhas e lentilhas, feijão branco, beterraba, agrião e muitos outros.
Os vegetais utilizam o ferro na síntese da clorofila.
O acúmulo de ferro no organismo pode levar a toxicidade. Sem ferro no organismo, este fica sujeito a anemias, porém em excesso pode causar a deposição do ferro nas células do fígado, ou no baço, na medula óssea, miocárdio e glândulas endócrinas em geral, levando a destruição celular local, fibrose e insuficiência do órgão.
Uso do Ouro
O ouro é utilizado como moeda de troca pelo povo antigo até nossos dias num período de 5000 anos, atualmente é utilizado como reserva monetária. Na joalheria, é utilizado na produção de ligas de prata e cobre na confecções de jóias. Na gastronomia é utilizado na decoração de doces e bolos, em microscopia é utilizado no revestimento de material biológico, o que permite a visualização através de microscopia eletrônica de varredura. Em eletrônica é também empregado na tecnologia de satélites artificiais, aplicado em placas de computadores, celulares, tela de televisão, câmeras fotográficas, também em revestimentos de vidros de janelas de edifícios para refletir a radiação infra vermelha impedindo a sua penetração nos ambientes.
O ouro também é utilizado industrialmente como catalisador acelerador de reações, na medicina nas aplicações terapêuticas do câncer (quimioterapia), no reumatismo na Aids, malária, problemas de pele e nas cirurgias, como malhas na restauração de vasos sanguíneos.
Cálculos
1) Sabendo que para ser produzido um quilograma de alumínio metálico puro, necessita-se em média de 2 quilogramas de alumina (Al2O3) que é obtida a partir de 4 ou 5 quilogramas de bauxita e 50 gramas de criolita (Na3AlF3). Com esse conhecimento pergunta-se: para se produzir uma tonelada de alumínio, quantos quilogramas de criolita são necessários?
Assinale a alternativa correta.
a) 0,5 kg b) 500 g c) 5,0 kg d) 5000 g e) 50 kg
Resolução

Exercícios
1) Assinale apenas a correta. Podemos definir os metais como sendo:
a) bons condutores de sons, de ondas, a estrutura atômica dos metais é compacta, possuem instabilidade, são duráveis quando expostos as intempéries sem proteção.
b) compostos de ferro, altamente resistentes á tração. Possuem intensa refletibilidade e leveza são isentos de corrosão e não se oxidam durante longo tempo de exposição.
c) maus condutores de eletricidade por esse motivo são isolantes, barram o calor a distância, não tem ductilidade e nem flexibilidade, por isso são duros e resistentes.
d) bons condutores de eletricidade, mas não de calor, a estrutura atômica dos metais é molecular covalente. Possuem, leveza, e os pontos de fusão e ebulição são baixos.
e) bons condutores de eletricidade, de calor, a estrutura atômica dos metais é a cristalina. Possuem, maleabilidade, ductilidade e os pontos de fusão e ebulição são altos.
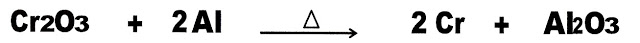 a) obtenção de ferro pelo processo siderúrgico.
a) obtenção de ferro pelo processo siderúrgico.
b) obtenção de cromo, pelo óxido de cromo III com alumínio metálico.
c) obtenção de cromo, pelo óxido de Cromo III Com Carbono.
d) obtenção da prata, pela ustulação da argentita (Ag2S).
e) obtenção de estanho por redução, pelo aquecimento da cassiterita com carbono.
3) O mineral zinco pode ser obtido industrialmente em duas etapas. A primeira etapa é de oxidação é a segunda etapa é de redução.
Observe a sequência da reação a seguir .
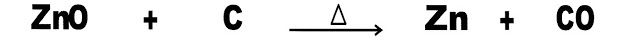
a) A reação apresentada é um processo de oxidação do óxido com carbono, em aquecimento.
b) A reação apresentada é um processo de redução do óxido com carbono, em aquecimento.
c) A reação é um processo siderúrgico para obter o metal zinco, em aquecimento.
d) A reação acima é o processo de ustulação do óxido de zinco, em aquecimento.
e) A reação é um processo com o uso do oxigênio em aquecimento para obtenção de zinco.
4) Os seres humanos também necessitam do ferro na alimentação para viver. O uma das funções do ferro além de várias outras, é estar presente na constituição da hemoglobina do glóbulo vermelho do sangue que é o responsável pelo transporte do oxigênio dos pulmões para as células. A falta do ferro no organismo causa vários tipos de transtornos, porém o ferro em excesso pode levar a depositar-se em órgãos como glândulas e tecidos e levar respectivamente a problemas como:
a) na falta causa arritmias ferroprivas, no aumento acima do normal, inibe a oxidação.
b) na falta causa tremores no corpo, no aumento acima do normal, neutrofilia.
c) na falta causa hiperemias passivas, no aumento acima do normal a ação da siderofilina.
d) na falta causa crises hematopoiéticas, no aumento acima do normal, hipervolemia.
e) na falta causa anemias ferroprivas, no aumento acima do normal, toxicidade e patologias.
5) O processo para obtenção de cobre metálico de altíssimo grau de pureza chama-se:
a) ustulação.
b) oxidação.
d) eletrolítico.
c) metalurgia.
d) galvanoplastia.
Bibliografia
Eduardo Leite Do Canto - Minerais, Minérios Metais, De Onde Vêm Para onde Vão? Editora Moderna 2002.
Antimônio - Wikipédia, a enciclopédia livre
https://pt.wikipedia.org/wiki/Antimônio...
Sobrecarga e quelação de ferro na anemia ... - SciELO
www.scielo.br/scielo.php?script+sci_arttext&pid=S1516...
d) bons condutores de eletricidade, mas não de calor, a estrutura atômica dos metais é molecular covalente. Possuem, leveza, e os pontos de fusão e ebulição são baixos.
e) bons condutores de eletricidade, de calor, a estrutura atômica dos metais é a cristalina. Possuem, maleabilidade, ductilidade e os pontos de fusão e ebulição são altos.
2) A reação a seguir é uma reação de:
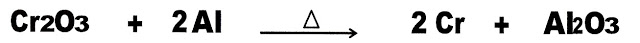
b) obtenção de cromo, pelo óxido de cromo III com alumínio metálico.
c) obtenção de cromo, pelo óxido de Cromo III Com Carbono.
d) obtenção da prata, pela ustulação da argentita (Ag2S).
e) obtenção de estanho por redução, pelo aquecimento da cassiterita com carbono.
3) O mineral zinco pode ser obtido industrialmente em duas etapas. A primeira etapa é de oxidação é a segunda etapa é de redução.
Observe a sequência da reação a seguir .
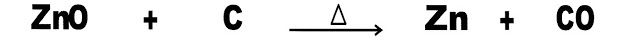
a) A reação apresentada é um processo de oxidação do óxido com carbono, em aquecimento.
b) A reação apresentada é um processo de redução do óxido com carbono, em aquecimento.
c) A reação é um processo siderúrgico para obter o metal zinco, em aquecimento.
d) A reação acima é o processo de ustulação do óxido de zinco, em aquecimento.
e) A reação é um processo com o uso do oxigênio em aquecimento para obtenção de zinco.
4) Os seres humanos também necessitam do ferro na alimentação para viver. O uma das funções do ferro além de várias outras, é estar presente na constituição da hemoglobina do glóbulo vermelho do sangue que é o responsável pelo transporte do oxigênio dos pulmões para as células. A falta do ferro no organismo causa vários tipos de transtornos, porém o ferro em excesso pode levar a depositar-se em órgãos como glândulas e tecidos e levar respectivamente a problemas como:
a) na falta causa arritmias ferroprivas, no aumento acima do normal, inibe a oxidação.
b) na falta causa tremores no corpo, no aumento acima do normal, neutrofilia.
c) na falta causa hiperemias passivas, no aumento acima do normal a ação da siderofilina.
d) na falta causa crises hematopoiéticas, no aumento acima do normal, hipervolemia.
e) na falta causa anemias ferroprivas, no aumento acima do normal, toxicidade e patologias.
5) O processo para obtenção de cobre metálico de altíssimo grau de pureza chama-se:
a) ustulação.
b) oxidação.
d) eletrolítico.
c) metalurgia.
d) galvanoplastia.
Bibliografia
Eduardo Leite Do Canto - Minerais, Minérios Metais, De Onde Vêm Para onde Vão? Editora Moderna 2002.
Antimônio - Wikipédia, a enciclopédia livre
https://pt.wikipedia.org/wiki/Antimônio...
Sobrecarga e quelação de ferro na anemia ... - SciELO
www.scielo.br/scielo.php?script+sci_arttext&pid=S1516...
Texto em construção.
loading...
- Ligas Metálicas
Ligas Metálicas Ligas Metálicas - Definição Nas Ligas metálicas deve haver dois ou mais componentes e pelo menos um componente é o principal. As...
- Cálculo Das Porcentagens Dos Elementos Químicos
Cálculo Das Porcentagens Dos Elementos Químicos Calcular as porcentagens dos elementos químicos presentes em uma fórmula molecular representativa de uma substância, é conhecer o quanto esses elementos são necessários na composição da substância. ...
- Eletrólise
Eletrólise Eletrólise A eletrólise de um modo geral é caracterizada por ser um processo de oxirredução ou de obtenção de íons livres com...
- LigaÇÃo Metalica
Bolsistas:Andressa G. e Loys L. Tudo bem galerinha do Quipibid??!!! Hoje iremos aprender um pouco de ligação metálica. Como sabemos os metais são ótimos condutores de eletricidade e calor. Muitos são maleáveis e dúcteis. Essas propriedades estão...
- Processo Industrial Do Ferro (fe)
Bolsista: Ana Lucia Miranda Olá leitores, nesta matéria iremos falar da produção industrial do ferro, que exerce um importantíssimo papel na economia de um país. Em nossas vidas, a siderurgia...
