Química
- Ácidos E Bases Segundo Arrhenius
Bolsista: Loys Laynne Rodrigues Sousa Olá galerinha, hoje vamos falar sobre os ácidos e as bases segundo a definição de Arrhenius.· Ácidos Arrhenius definiu ácidos como compostos...
- As Aventuras De Pi
...
- O Que é Um ácido???
...
- Azul De Bromotimol
Titulação Ácido-Base Azul de bromotimol Azul de bromotimol (4,4'-(1,1-dioxido-3H-2,1-benzoxatiola-3,3-di-il)bis(2-bromo-6-isopropil-3-metilfenol)) é um dos indicadores ácido-base mais comuns em laboratório. Ele é adequado para determinações...
- Recuperação De Conteúdo - Soluções - Atividade N° 03
Colégio Estadual...........................................................Aluno(a):..................................................................Série....... Turma..... Data......../........../......... Nota:........ ???...
Química
pH e pOH
pH e pOH
Conceitos Fundamentais de pH e pOH
pH
pH
pH significa potencial hidrogeniônico, ou ainda o quanto de H+ há livre numa solução ou meio aquoso. Segundo Bronsted é o hidrogênio na forma de próton, ou do íon cátion que promove a característica ácida de uma substância.
O pH com o caráter ácido vai de zero até 6,9.
O pH neutro é o pH da água pura que possui o ponto igual a 7.
O pH de caráter básico vai de 7,1 até 14.
pOH
pOH
O pOH significa potencial hidroxiliônico Indica, o quanto de OH- há livres numa solução aquosa.
A constante de ionização de um ácido tem como símbolo o Ka
Valores de Ka, Constante de Ionização de Alguns Ácidos
Substâncias Alcalinas
O pOH que possui o caráter alcalino ou básico vai de 14 a 7,1.
O pOH de uma solução aquosa sem a característica de basicidade vai de 6,9 até zero.
Substâncias Ácidas e Alcalinas
Substâncias Ácidas
Substâncias que tem características ácidas e liberam o íon hidrogênio H+. São todos os ácidos inorgânicos. O ácido clorídrico (HCl), perclórico (HClO4) sulfúrico (H2SO4) ácido fosfórico (H3PO4), ácido carbônico (H2CO3). Os ácidos orgânicos, são, o ácido acetil salicilico (C9H8O4), ácido ascórbico (C6H8O6), ácidos carboxílicos ácido acético (CH3COOH), ácidos graxos, gorduras etc.
Ka
Constante de Ionização de um Ácido
Ka
Constante de Ionização de um Ácido
A constante de ionização de um ácido tem como símbolo o Ka
Valores de Ka, Constante de Ionização de Alguns Ácidos
Ácido | Cátion | Ânion | Ka | ||
HCl ácido forte | H+ | + | Cl- | ~ 10-7 | |
H2SO4 ácido forte | H+ | + | SO4- | ~ 10-7 | |
H2SO3 ácido forte | H+ | + | SO3- | 1,3 . 10-2 | |
H3PO4 | H+ | + | PO4- | 7,5 . 10-3 | |
HCOOH | H+ | + | HCOO- | 1,7 . 10-4 | |
HF | H+ | + | F- | 2,4 . 10-4 | |
HNO2 | H+ | + | NO2- | 5,1 . 10-4 | |
CH3COOH | H+ | + | CH2COO- | 1,8 . 10-5 | |
H2CO3 | H+ | + | HCO3- | 4,6 . 10-7 | |
H2S | H+ | + | HS- | 1,0 . 10-7 | |
HCN | H+ | + | CN- | 4,9 . 10-10 |
Substâncias Alcalinas
Substâncias com características alcalinas ou básicas são as bases inorgânicas o hidróxido de sódio (NaOH), hidróxido de potássio (KOH), hidróxido de lítio (LiOH) hidróxido de cálcio (CaOH2) hidróxido de magnésio (MgOH2). Substâncias orgânicas, o leite, a batata, o repolho, couve, brócolis, todas tem características alcalinas, igualmente muitas proteínas possuem caráter alcalino, ou possuem comportamento de substância alcalina.
Kb
Constante de Ionização de uma Base
A constante de ionização para uma base tem como símbolo Kb

pHmetro
A foto ao lado mostra um dos diversos modelos de pHmetro para a medida do pH das soluções.
Foto retirada do arquivo da web
Logaritmos
Para calcular o pH e pOH utiliza-se logaritmos. Nesse caso é necessário um pouco de conhecimento do respectivo assunto.
Kb
Constante de Ionização de uma Base
A constante de ionização para uma base tem como símbolo Kb
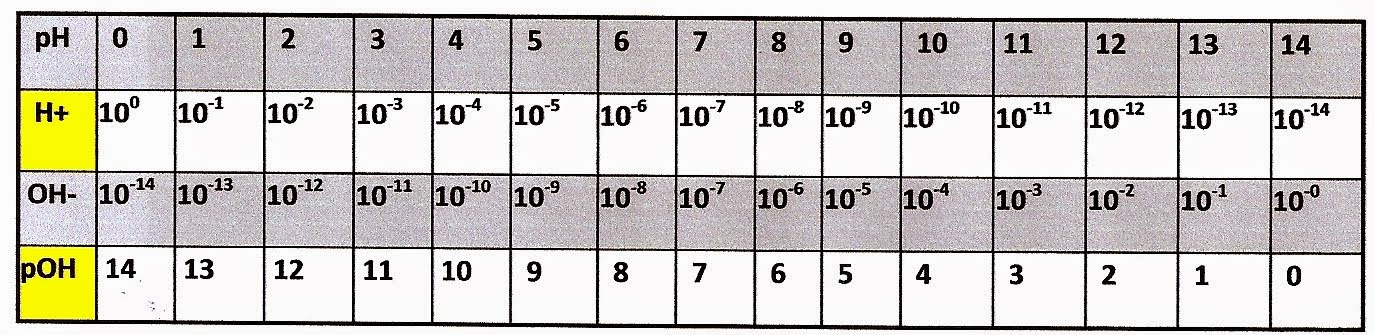
Escala do pH
A escala indica se o pH é baixo a substância é ácida, se o pH é alto a substância tem o caráter alcalino.
Se a substância possui o pH = 1 a substância é um ácido forte.
No entanto se a substância possuir pH = 14 o pOH será zero, o que significa que a substância é altamente alcalina. Veja a tabela abaixo.
 Modos de Expressão do pH
Modos de Expressão do pH
 Modos de Expressão do pH
Modos de Expressão do pHSe o pH for zero, representamos assim 100 .Como todo número elevado a zero é 1, então; há 1 mol/L de H+ na solução aquosa. A solução é muito ácida.
Se o pH for 1, podemos representar assim 10-1 ou 0,1. Nesse caso há 0,1 mol/L de H+ livre na solução aquosa.
Se o pH for 2, podemos representar assim 10-2 ou 0,01. Nesse caso há 0,01 mol/L de H+ para na solução aquosa. A solução possui 0,01 mol de H+ livre na solução.
Se o pH for 3, podemos representar assim 10-3 ou 0,001. Nesse caso há 0,001 mol/L de H+ na solução aquosa. A solução possui 0,001 mol de H+ livre na solução.
Se o pH for 4, podemos representar assim 10-4 ou 0,0001. Nesse caso há 0,0001 mol/L de H+ na solução aquosa. A solução possui 0,0001 mol de H+ livre na solução.
Se o pH for 5, podemos representar assim 10-5 ou 0,00001. Nesse caso há 0,00001 mol/L de H+ na solução aquosa. A solução possui 0,00001 mol de H+ livre na solução.
Modos de Expressão do pOH
Se o pH for 14, a representação é 10-14. O pOH é zero, representamos assim 100 .Como todo número elevado a zero é 1, então; há 1 mol de íons OH- para cada litro de solução. A solução é extremamente alcalina.
Se o pH for 13, a representação é 10-13. O pOH é 0,1, podemos representar assim; 10-1 ou 0,1 . Nesse caso há 0,1 mol de OH- diluído na solução aquosa. A solução é formada por 0,1 mol/L de OH- livre na solução. A solução é muito alcalina.
Se o pH for 12, a representação é 10-12 . O pOH é 2, podemos representar assim; 10-2 ou 0,01. Nesse caso há 0,01 mol/L de OH- na solução aquosa. A solução é formada por 0,01 mol de OH- livres na solução. A solução é muito alcalina.
Se o pH for 11, a representação é 10-11. O pOH é 3, podemos representá-lo assim; 10-3 ou 0,001. Nesse caso há 0.001 mol/L de OH- na solução aquosa. A solução é formada por 6,02 x 1020 de OH- livres em 1 litro de solução. A solução é alcalina.
Se o pH for 10, a representação e 10-10 O pOH é 4, podemos representá-lo assim; 10-4 ou 0,0001. Nesse caso há 0,0001 mol/L de OH- na solução aquosa. A solução é formada por 6,02 x 1019 partículas de OH- livres em um litro da solução.
Indicadores do pH
Fenolftaleina - em meio alcalino apresenta a cor rosa, em meio ácido é incolor.
ácido | |
alcalino |
Alaranjado de metila, metil oranje - em meio alcalino ? tom amarelado, em meio ácido o tom é avermelhado.
alcalino | |
ácido |
Azul de bromotimol ? em solução ácida fica amarelo em solução neutra fica verde e em solução alcalina fica azul.
ácido | |
neutro | |
alcalina |
Papel tornassol ? ácido ? vermelho, alcalino - azul.
ácido | |
alcalino |

pHmetro
A foto ao lado mostra um dos diversos modelos de pHmetro para a medida do pH das soluções.
Foto retirada do arquivo da web
Logaritmos
Para calcular o pH e pOH utiliza-se logaritmos. Nesse caso é necessário um pouco de conhecimento do respectivo assunto.
Logaritmos Decimais
A tabela abaixo mostra a série de números decimais e seus respectivos logaritmos.
Já que conhecemos alguns valores de logaritmos, passamos a usa-lo nos cálculos do pH.
Exercícios


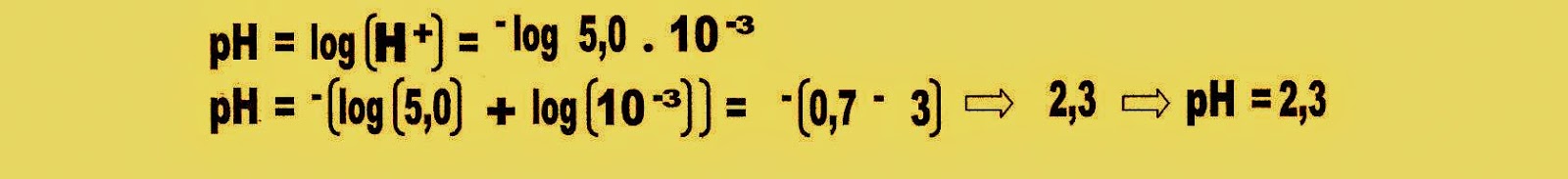 O suco de limão tem pH 2,3.
O suco de limão tem pH 2,3.
3) Vunesp - (Adaptado) O ácido clorídrico (HCl) é um ácido forte que se dissocia totalmente em solução aquosa. Ao preparar uma solução de concentração 0,1 mol/L, a 25ºC, pergunta-se: qual é o pOH dessa solução?
HCl
HCl = 0,10 mol/L H+ = 0,10 mol/L Cl- = 0,10 mol/L
H+ = 10-1 mol/L
H+ = 10-1 ------pH = -log10-1 = 101 então 101 = 1,0log 10 = 1
pH = 1
Se pH = pOH = 14
então pOH = 14 - pH =1
pOH = 14 - 1 = 13
pOH = 13
Texto em construção Prof. Antonio 07/04/2014
A tabela abaixo mostra a série de números decimais e seus respectivos logaritmos.
Número | Logarítmo | |
1 | 0 | |
2 | 0,30 | Log 2 = 0,3 = 100,3 |
3 | 0,48 | Log 3 = 0,48 = 100,48 |
4 | 0,60 | Log 4 = 0,60 = 100,60 |
5 | 0,70 | Log 5 = 0,70 = 100,70 |
6 | 0,78 | Log 6 = 0,78 = 100,78 |
7 | 0,85 | Log 7 = 0,85 = 100,85 |
8 | 0,90 | Log 8 = 0,90 = 100,90 |
9 | 0,95 | Log 9 = 0,95 = 100,95 |
10 | 1 | Log 10 = 1 = 101 |
Já que conhecemos alguns valores de logaritmos, passamos a usa-lo nos cálculos do pH.
Exercícios
1) Se a acidez de um suco de limão puro apresenta o valor de 0,005 mol/L de H+, encontre o pH desse suco?
Primeiramente deve-se transformar o valor 0,005 em potência de dez.

Encontramos o logaritmo de cinco

Com os dados obtidos acima passamos ao cálculo do pH do suco do limão.
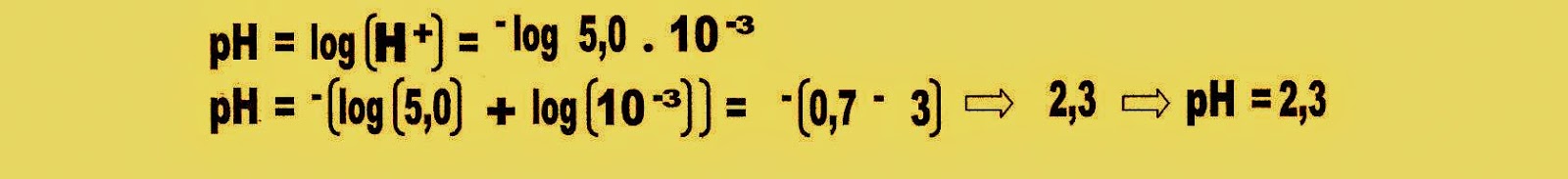
2) Adaptado - Em um laboratório, um estudante preparou em um balão volumétrico 1 litro de uma solução com 0,005 mol/L de H2SO4. Ao terminar de preparar a solução, ele quis saber qual o pH dessa solução e recorreu ao cálculo.
Para todo ácido forte considera-se ? = 100 % a sua diluição.
H2SO4 ? 2 H+ + SO4-2 (? = 100 %)
0,005 mol/L de H2SO4 ? 0,005 . 2 mol/L de H+
H+ = 0,005 . 2 = 0,010 = 10-2 mo/L ? pH = 2
O pH dessa solução ácida é = 2
3) Vunesp - (Adaptado) O ácido clorídrico (HCl) é um ácido forte que se dissocia totalmente em solução aquosa. Ao preparar uma solução de concentração 0,1 mol/L, a 25ºC, pergunta-se: qual é o pOH dessa solução?
HCl
HCl = 0,10 mol/L H+ = 0,10 mol/L Cl- = 0,10 mol/L
H+ = 10-1 mol/L
H+ = 10-1 ------pH = -log10-1 = 101 então 101 = 1,0log 10 = 1
pH = 1
Se pH = pOH = 14
então pOH = 14 - pH =1
pOH = 14 - 1 = 13
pOH = 13
Texto em construção Prof. Antonio 07/04/2014
loading...
- Ácidos E Bases Segundo Arrhenius
Bolsista: Loys Laynne Rodrigues Sousa Olá galerinha, hoje vamos falar sobre os ácidos e as bases segundo a definição de Arrhenius.· Ácidos Arrhenius definiu ácidos como compostos...
- As Aventuras De Pi
...
- O Que é Um ácido???
...
- Azul De Bromotimol
Titulação Ácido-Base Azul de bromotimol Azul de bromotimol (4,4'-(1,1-dioxido-3H-2,1-benzoxatiola-3,3-di-il)bis(2-bromo-6-isopropil-3-metilfenol)) é um dos indicadores ácido-base mais comuns em laboratório. Ele é adequado para determinações...
- Recuperação De Conteúdo - Soluções - Atividade N° 03
Colégio Estadual...........................................................Aluno(a):..................................................................Série....... Turma..... Data......../........../......... Nota:........ ???...
