Química
- Oxidos
A Definição Para os Óxidos Óxido são substâncias formadas pelo elemento químico oxigênio que é o mais eletronegativo presente em sua estrutura molecular e qualquer outro elemento químico que seja diferente do flúor, pois o flúor possui...
- Questões Sobre Gases E Cinética Química
Primeiro...
- Avaliação - Caderno Do Aluno - Química, Volume 1, 2ª Série
Avaliação Questões Para o 2° Ano...
- A Água E As Suas Propriedades
Quais São as Propriedades da Água? A Temperatura de Ebulição Uma das propriedades da água pura é entrar em ebulição a zero metro de altitude e pressão de uma atmosfera a 100 ºC (graus Celsius). A Temperatura de Fusão Outra...
- Poluição Do Ar
Bolsista: Monika Vapores diferentes. O ar atmosférico é basicamente composto por oxigênio (21%), nitrogênio (78%), gás O ar da atmosfera, fina camada gasosa que envolve a Terra, é uma mistura de muitos tipos de gases e carbônico (0,03%) e mais...
Química
ppm, ppb
ppm e ppb
Ppm - partículas por milhão, ou ppb partículas por bilhão, são unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, ou nas dispersões de coloides em quantidades pequeníssimas presente num sistema.
Num exemplo prático, são medidas que permitem determinar se as quantidades de partículas de gases nocivos, partículas de pó fino, fuligens, ou poeira presentes na atmosfera de uma grande cidade, ou região, estão ou não alteradas pela atividade humana ou mesmo pela ação da natureza. Essas unidades de medida permitem avaliar se um local se encontra em condições normais, ou com a taxa de poluentes em excesso no ar, no solo nas águas, torna-se possível determinar se um composto químico nocivo á saúde humana ou para o meio ambiente está ou não presente em quantidades alteradas. Faz-se esse tipo de pesquisa, especialmente para determinar a presença na água de metais pesados como o chumbo (Pb), o mercúrio (Hg), ou particulados tóxicos como inseticidas herbicidas que podem ser ingeridos pela população ou que podem danificar o ambiente em geral.
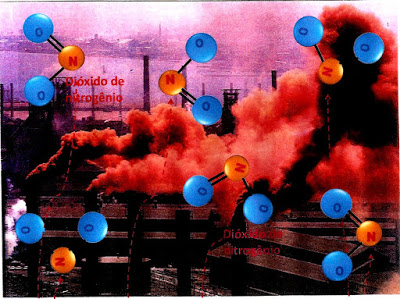 A figura ao lado mostra uma industria poluente do meio ambiente. A cor marron da fumaça pode indicar que um
A figura ao lado mostra uma industria poluente do meio ambiente. A cor marron da fumaça pode indicar que um
dos compostos é o dióxido de nitrogênio.
Dados dos Componentes Presentes na Atmosfera da Região da Grande São Paulo
O gás dióxido de enxofre (SO2), a média dos dados de três amostras, coletadas em três lotes num intervalo de 24 horas, foi de 43,3 µg/m3 . A PF (padrões determinados) ideal para não ser prejudicial à saúde seria de 20 µg/m3. Dados obtidos da Cetesb.
Origem e Efeitos Nocivos do SO2
As origens naturais do SO2 são vulcões em atividade, outra fonte são como aerossois marinhos que da água emite para a atmosfera sulfato SO4-2 ou ainda por espécies bacterianas (orígem biogênica) que metabolizam compostos com enxofre que acabam sendo liberados para a atmosfera. Os veículos automotores possuem catalisadores metálicos que praticamente elimina a emissão do enxofre (S) para a atmosfera.
As estimativas da quantidade desse gás na atmosfera fica entre 130 a 180 x 1012g por ano de enxofre (S) ou seja uma estimativa mais de 150 milhões de toneladas de enxofre (S) por ano. A outra origem do gás para a atmosfera é a antropogênica, pela queima de combustíveis fósseis com enxofre , ou seja, o diesel, o carvão e as usinas termelétricas que utilizam como combustível material que contém enxofre, da mesma forma é a queima do petróleo bruto em muitas industrias produtoras de energia, ou de cimento, e de fundição e metalurgia. O gás na atmosfera forma a chuva ácida ao combinar-se com a umidade do ar, nas plantas interfere no processo da fotossíntese, provoca ainda a necrose das folhas facilitando atividades de fungos e outros parasitas destruidores dos vegetais. Esse gá na forma de chuva, também é capaz de deteriorar edificações, provoca corrosão e envelhecimento das construções, atinge materiais metálicos oxidando-os, é capaz de acidificar corpos de água, e destruir florestas inteiras.
No ser humano causa ardência dos olhos, problemas respiratórios como irritação do sistema respiratório superior com produção de muco, pode levar a asma, atinge o ser humano de outras formas chegando a interferir no processo normal do sistema cardiovascular ou prejudicar ainda mais as pessoas com problemas cardiovasculares.
Gás ozônio
O gás Ozônio (O3), a média dos dados de três amostras, coletadas em três lotes num intervalo de 8 horas, foi de 130 µg/m3 . A PF (padrões determinados) ideal para não ser prejudicial à saúde seria de 100 µg/m3. Dados obtidos da Cetesb.
Substâncias Presentes na Água em ppm
Gás Oxigênio
Exercícios
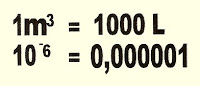
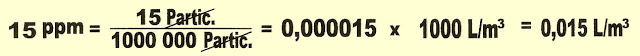
Ou podemos resolver da mesma forma:

Resolução - Como transformar 0,05 g e 106 g de Pb2+ em porcentagem.
Primeiramente devemos ter pelo menos uma pequena noção de porcentagens.
Por exemplo :
100 % = 100 partes em 100.
10 % = 10 partes em 100.
1 % = 1 parte em 100.
0,1 % = 0,1 parte em 100 = 1 parte em 1000.
0,01 % = 0,01 parte em 100 = 1 parte em 10 000.
0,001 % = 0,001 parte em 100 = 1 parte em 100 000.
0,0001 % = ,00001 parte em 100 = 1 parte em 1000 000.
Então a resolução do problema fica:
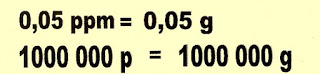
0,05 é o soluto que está na proporção de 10 000 vezes menor na solução . E o valor 10 000 passa a ser o divisor dessa massa:


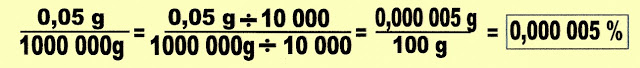
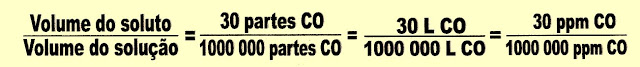
Dados. Observe que o quilograma corresponde a um milhão de partes.
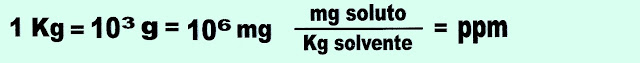

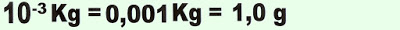
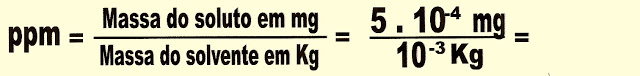

Ou ainda podemos resolver:

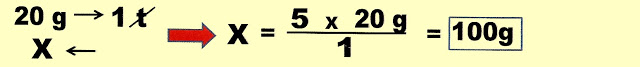
Bibliografia
Ppm - partículas por milhão, ou ppb partículas por bilhão, são unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, ou nas dispersões de coloides em quantidades pequeníssimas presente num sistema.
Num exemplo prático, são medidas que permitem determinar se as quantidades de partículas de gases nocivos, partículas de pó fino, fuligens, ou poeira presentes na atmosfera de uma grande cidade, ou região, estão ou não alteradas pela atividade humana ou mesmo pela ação da natureza. Essas unidades de medida permitem avaliar se um local se encontra em condições normais, ou com a taxa de poluentes em excesso no ar, no solo nas águas, torna-se possível determinar se um composto químico nocivo á saúde humana ou para o meio ambiente está ou não presente em quantidades alteradas. Faz-se esse tipo de pesquisa, especialmente para determinar a presença na água de metais pesados como o chumbo (Pb), o mercúrio (Hg), ou particulados tóxicos como inseticidas herbicidas que podem ser ingeridos pela população ou que podem danificar o ambiente em geral.
 A figura ao lado mostra uma industria poluente do meio ambiente. A cor marron da fumaça pode indicar que um
A figura ao lado mostra uma industria poluente do meio ambiente. A cor marron da fumaça pode indicar que umdos compostos é o dióxido de nitrogênio.
Dados dos Componentes Presentes na Atmosfera da Região da Grande São Paulo
Para melhor nos inteiramos de dados reais, podemos nos basear no trabalho da CETESB. Há estações da CETESB de medição da composição do ar da cidade de São Paulo e grande São Paulo, que mede os componentes do ar, como o dióxido de enxofre SO2, ozônio O3, monóxido de nitrogênio NO, dióxido de nitrogênio NO2, o monóxido de carbono CO, dióxido de carbono CO2, metano (CH4), e partículas de poeira presentes no ar. Isso é feito e anotado de acordo com o horário, o dia e a sua concentração no período das medições.
Partículas Inaláveis
Partículas inaláveis (M10) de 10 micras para menos, coletadas em 3 lotes de amostras em 24 horas, a média das amostras foi de 98,3 µg/m3. Essas partículas inaláveis seriam partículas poeira, neblina, aerossol, fumaça, fuligem. A PF (padrões determinados) como ideal para a saúde seria de 50 µg/m3. Dados obtidos da Cetesb.
São partículas inaláveis < que 10 micras, o pólen de abelhas ou das flores das angiospermas. Os aerosois marinhos são os sais marinhos liberados nas arrebentações das ondas nas bolhas de ar que estouram liberando no ar sais que podem permanecer na atmosfera por alguns minutos e até semanas. Os aerosois do solo são a poeira fina, também podem se enquadrar nesse grupo os biogênicos, os fungos, esporos, bactérias e fragmentos de folhas.
Danos no Organismo Humano por Partículas Inaláveis
Danos no Organismo Humano por Partículas Inaláveis
Essas partículas de tamanho por volta de 10 micras para menos, podem causar para os seres humanos o aumento de atendimentos hospitalares por alergias, crises de asma, rinite alérgica, e mortes prematuras. Em longos períodos de exposições ocorre Insuficiências respiratórias, chiado no peito, falta de ar, isso acontece devido a um longo período de deposição destes poluentes que vão acumulando nos pulmões.
Partículas Inaláveis finas
Partículas inaláveis finas (MP2,5) de 2,5 micras para menos, coletadas em 3 lotes de amostras em 24 horas, a média das amostras foi de 49 µg/m3. Essas partículas inaláveis seriam partículas poeira, neblina, aerossol, fumaça, fuligem. A PF (padrões determinados) como ideal para a saúde seria de 25 µg/m3. Dados obtidos da Cetesb.
Dióxido de Nitrogênio
Dióxido de nitrogênio (NO2 ), gás marrom avermelhado, com odor forte e muito irritante, a média dos dados de três amostras coletadas em intervalos de 1 hora, foi de 240 µg/m3 . A PF (padrões determinados) ideal para não ser prejudicial à saúde seria de 200 µg/m3. Esse gás na atmosfera pode levar à formação de ácido nítrico, causador da chuva ácida e de nitratos. Dados obtidos da Cetesb.
Dióxido de Enxofre O gás dióxido de enxofre (SO2), a média dos dados de três amostras, coletadas em três lotes num intervalo de 24 horas, foi de 43,3 µg/m3 . A PF (padrões determinados) ideal para não ser prejudicial à saúde seria de 20 µg/m3. Dados obtidos da Cetesb.
Origem e Efeitos Nocivos do SO2
As origens naturais do SO2 são vulcões em atividade, outra fonte são como aerossois marinhos que da água emite para a atmosfera sulfato SO4-2 ou ainda por espécies bacterianas (orígem biogênica) que metabolizam compostos com enxofre que acabam sendo liberados para a atmosfera. Os veículos automotores possuem catalisadores metálicos que praticamente elimina a emissão do enxofre (S) para a atmosfera.
As estimativas da quantidade desse gás na atmosfera fica entre 130 a 180 x 1012g por ano de enxofre (S) ou seja uma estimativa mais de 150 milhões de toneladas de enxofre (S) por ano. A outra origem do gás para a atmosfera é a antropogênica, pela queima de combustíveis fósseis com enxofre , ou seja, o diesel, o carvão e as usinas termelétricas que utilizam como combustível material que contém enxofre, da mesma forma é a queima do petróleo bruto em muitas industrias produtoras de energia, ou de cimento, e de fundição e metalurgia. O gás na atmosfera forma a chuva ácida ao combinar-se com a umidade do ar, nas plantas interfere no processo da fotossíntese, provoca ainda a necrose das folhas facilitando atividades de fungos e outros parasitas destruidores dos vegetais. Esse gá na forma de chuva, também é capaz de deteriorar edificações, provoca corrosão e envelhecimento das construções, atinge materiais metálicos oxidando-os, é capaz de acidificar corpos de água, e destruir florestas inteiras.
No ser humano causa ardência dos olhos, problemas respiratórios como irritação do sistema respiratório superior com produção de muco, pode levar a asma, atinge o ser humano de outras formas chegando a interferir no processo normal do sistema cardiovascular ou prejudicar ainda mais as pessoas com problemas cardiovasculares.
Gás ozônio
O gás Ozônio (O3), a média dos dados de três amostras, coletadas em três lotes num intervalo de 8 horas, foi de 130 µg/m3 . A PF (padrões determinados) ideal para não ser prejudicial à saúde seria de 100 µg/m3. Dados obtidos da Cetesb.
Substâncias Presentes na Água em ppm
Gás Oxigênio
O gás oxigênio dissolvido na água depende relativamente da altitude do relevo da terra, da pressão parcial desse gás na atmosfera e da temperatura.
Com o aumento da altitude do relevo, decresce a pressão parcial do gás oxigênio na atmosfera, e em consequência diminui o oxigênio diluído na água, com o aumento da temperatura da água também decresce o nível de gás oxigênio diluído na água.
Experimentos revelam que a temperatura de zero grau Celsius e 1 atmosfera de pressão, a concentração do gás oxigênio na água é de 14,2 mg/ litro de água. A uma temperatura de 25 ºC e a mesma pressão atmosférica a concentração desse gás na água é por volta de 8,6 mg/L-1.
Exercícios
1) Adaptado - Pede-se para calcular o volume do monóxido de carbono (CO) existente por metro cúbico de ar da cidade de São Paulo. Visto que, esse gás interfere na qualidade do ar, quando o teor de monóxido de carbono ultrapassar 15 ppm V/V. Sendo esse o dado obtido na amostragem, faça o cálculo.
Resolução
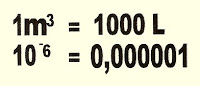
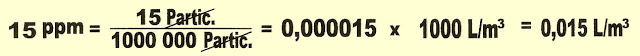
Ou podemos resolver da mesma forma:

2) O chumbo na forma de íon cátion Pb2+ pode estar diluído na água potável até 0,05 ppm sem causar dano á saúde humana. Tendo conhecimento desse valor, transforme a solução 0,05 ppm, em grama e depois para porcentagem de chumbo presente na água.
Resolução - Como transformar 0,05 g e 106 g de Pb2+ em porcentagem.
Primeiramente devemos ter pelo menos uma pequena noção de porcentagens.
Por exemplo :
100 % = 100 partes em 100.
10 % = 10 partes em 100.
1 % = 1 parte em 100.
0,1 % = 0,1 parte em 100 = 1 parte em 1000.
0,01 % = 0,01 parte em 100 = 1 parte em 10 000.
0,001 % = 0,001 parte em 100 = 1 parte em 100 000.
0,0001 % = ,00001 parte em 100 = 1 parte em 1000 000.
Então a resolução do problema fica:
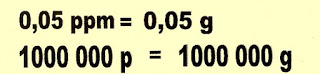
0,05 é o soluto que está na proporção de 10 000 vezes menor na solução . E o valor 10 000 passa a ser o divisor dessa massa:

A mesma coisa acontece com a solução em que está diluído o soluto:

Então para transformar 0,05 g em porcentagem utiliza-se da seguinte fórmula.
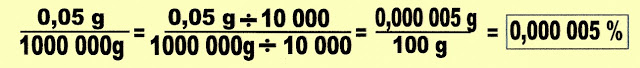
3) Os dados apresentados numa medição do CO atmosferico do ar de uma das cidades da Grande São Paulo apresentou a seguinte concentração: 30 partes de CO. Represente esse valor em litros e em ppm.
Podemos esquematizar os valores pedidos pela seguinte equação:
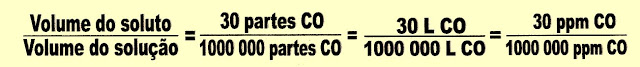
4) O mercúrio é um metal pesado, líquido, cujo ponto de fusão é de -38,9 ºC, é muito tóxico, pode ser aspirado ou ingerido, acumula-se nos órgãos e no sistema nervoso, pode levar à perda de memória, à vida vegetativa ou até à morte, no organismo em geral pode causar, diarreia, tremores, depressão, ansiedade. Numa amostra de água potável coletada, a análise revelou 5,0 . 10-4 mg de mercúrio (Hg) por grama da água. Sendo esse o limite máximo permitido na água para consumo humano. Expresse esse valor em ppm.
Resolução.
Dados. Observe que o quilograma corresponde a um milhão de partes.
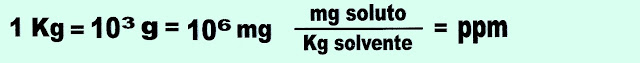

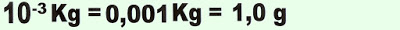
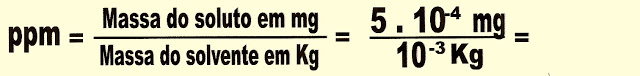

Ou ainda podemos resolver:

5) Uma industria produtora de corante sintético orgânico, controlando as impurezas como o chumbo em seu produto, permite que o máximo desse elemento químico presente seja de 20 ppm. Pergunta-se, em 5 toneladas do corante, qual é o máximo de chumbo permitido em gramas?




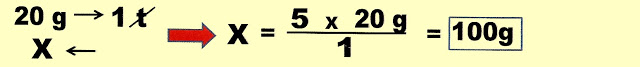
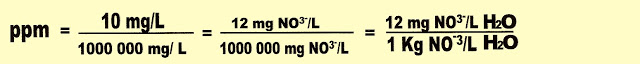
6) A Organização Mundial da Saúde (OMS) proíbe a distribuição e o consumo de água que tenham mais de 10 ppm de nitratos (NO3-). Uma lactante, por ingerir água de um poço com alta concentração de NO3-, pode ter em seu leite alta concentração de Nitritos (NO2-), Isso causaria ao bebê, uma forma de anemia muito grave, chamada de metaemoglobinemia. A água de um certo poço, ao ser analisada, revelou uma concentração de NO3-igual a 12 mg/L. Diga se a água é própria ou imprópria para beber, comparando o dado da OMS e o resultado da análise.
Resolução.

A água é imprópria para a mulher beber, porque a concentração de NO3- está dois pontos acima da quantidade máxima permitida.
7) Conforme dados obtidos experimentalmente, o gás oxigênio (O2) a 1 atmosfera de pressão e 0 °C de temperatura, no ambiente natural, está diluído na água na concentração de 14,2 mg/L de água. Transforme esse valor do oxigênio obtido em ppm.
Resolução

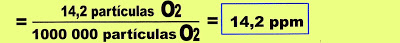
Exercícios
1) podemos definir ppm, partículas por milhão, ou ppb partículas por bilhão como:
a) unidades de medidas utilizadas para determinar a massa das moléculas ou substâncias iônicas, ou mesmo o mol de elétrons presentes em soluções salinas, em que os solutos se apresentam em grandes quantidades.
b) unidades de medidas utilizadas para determinar o volume e a massa dos solutos presentes em soluções muito concentradas.
c) unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, e nas dispersões de coloides em quantidades muito grandes de um sistema.
d) unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, ou nas dispersões de coloides em quantidades pequeníssimas presente num sistema.
e) unidades de medidas utilizadas para determinar o número de mol dos solutos de soluções muito diluídas, e das dispersões coloidais em quantidades pequeníssimas presente num sistema.
2) Uma industria produtora de corante sintético orgânico, controlando as impurezas como o chumbo em seu produto, permite que o máximo desse elemento químico presente na composição seja de 20 ppm. Pergunta-se, em 5 toneladas do corante, a massa em gramas de chumbo permitido é:
a) 0,10
b) 1,0
c) 10,0
d) 75,0
e) 100,0
3) O gás oxigênio dissolvido na água depende relativamente de três fatores, da altitude do relevo da terra, da pressão parcial local desse gás na atmosfera e da temperatura. Pergunta-se: numa altitude elevada, num dia quente o que acontece com o oxigênio da água?
a) Se decresce a pressão parcial do gás oxigênio na atmosfera e se aumentar a temperatura da água, aumenta o nível de gás oxigênio diluído na água.
b) se decresce a pressão parcial do gás oxigênio na atmosfera e se aumentar a temperatura da água, decresce o nível de gás oxigênio diluído na água.
c) se a pressão parcial do gás oxigênio na atmosfera é normal e se diminuir a temperatura da água, decresce o nível de gás oxigênio diluído na água.
d) se aumentar a pressão atmosférica ambiente e se aumentar a temperatura da água além do limite normal, aumenta o nível de gás oxigênio diluído na água.
e) a pressão parcial do gás oxigênio na atmosfera e o aumento da temperatura da água, não tem nada a ver com o nível de gás oxigênio diluído na água.
4) As orígens naturais do SO2, são os vulcões em atividade, podemos citar ainda outra fonte importante desse poluente ambiental, que são liberados como aerossois marinhos, que da água ganham a atmosfera na forma de sulfato SO42-, outro meio de emissão é feito ainda por espécies bacterianas (orígem biogênica) que metabolizam os compostos com enxofre que acabam sendo liberados para a atmosfera. Os veículos automotores possuem catalisadores metálicos que praticamente elimina a emissão do enxofre (S) para a atmosfera.
Já a orígem antropogênica se dá pela queima de combustíveis fósseis com enxofre, como o diesel, o carvão usado em usinas termelétricas, e a queima do petróleo bruto em muitas industrias produtoras de energia, ou produtoras de cimento, de fundição, e de metalurgia.
Com base nessas afirmações podemos dizer que esse poluente causa no ser humano:
a) problemas nos ossos, cartilagens, e musculatura esquelética, com produção de lactato, levando a sintomas de dores por todo corpo, interfere no processo normal do corpo em geral.
b) problemas econômicos, por causa da produção de compostos nocivos para o meio ambiente causando aumento da temperatura global com aumento de concentração de umidade excessiva na atmosfera provocando enchentes catastróficas.
c) problemas respiratórios, com irritação do sistema respiratório superior, com produção de muco, levando a sintomas de asma, interfere no processo normal do sistema cardiovascular e prejudica ainda mais as pessoas com problemas cardiovasculares.
d) problemas digestivos, com irritação da mucosa intestinal provocando diarreias, fraquezas e mal estar em geral, além da produção de gases em excesso. Ocorre também a produção de muco nos pulmões, levando a tosses, sintomas de falta de ar bronquites e asma.
e) problemas na flora e fauna por causa do desequilíbrio ambiental causado pela chuva ácida, acidificação do solo e da água dos rios e lagos, diminuindo a produção de alimentos que atinge diretamente os seres humanos provocando a escassez de alimentos.
5) O mercúrio é um metal pesado, líquido, cujo ponto de fusão é de -38,9 ºC, é muito tóxico, pode ser aspirado ou ingerido, acumula-se nos órgãos e no sistema nervoso, pode levar à perda de memória, à vida vegetativa ou até à morte, no organismo em geral pode causar, diarreia, tremores, depressão, ansiedade. Numa amostra de água potável coletada, a análise revelou 5,0 . 10-4 mg de mercúrio (Hg) por grama da água. Sendo esse o limite máximo permitido na água para consumo humano, assinale o valor expresso em ppm.
a) 0,05 ppm.
b) 5,0 ppm.
c) 1,1 ppm.
d) 0,5 ppm.
e) 0,15 ppm.
Resolução

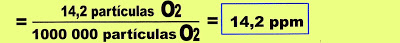
Exercícios
1) podemos definir ppm, partículas por milhão, ou ppb partículas por bilhão como:
a) unidades de medidas utilizadas para determinar a massa das moléculas ou substâncias iônicas, ou mesmo o mol de elétrons presentes em soluções salinas, em que os solutos se apresentam em grandes quantidades.
b) unidades de medidas utilizadas para determinar o volume e a massa dos solutos presentes em soluções muito concentradas.
c) unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, e nas dispersões de coloides em quantidades muito grandes de um sistema.
d) unidades de medidas utilizadas para determinar substâncias ou solutos presentes em soluções muito diluídas, ou nas dispersões de coloides em quantidades pequeníssimas presente num sistema.
e) unidades de medidas utilizadas para determinar o número de mol dos solutos de soluções muito diluídas, e das dispersões coloidais em quantidades pequeníssimas presente num sistema.
2) Uma industria produtora de corante sintético orgânico, controlando as impurezas como o chumbo em seu produto, permite que o máximo desse elemento químico presente na composição seja de 20 ppm. Pergunta-se, em 5 toneladas do corante, a massa em gramas de chumbo permitido é:
a) 0,10
b) 1,0
c) 10,0
d) 75,0
e) 100,0
3) O gás oxigênio dissolvido na água depende relativamente de três fatores, da altitude do relevo da terra, da pressão parcial local desse gás na atmosfera e da temperatura. Pergunta-se: numa altitude elevada, num dia quente o que acontece com o oxigênio da água?
a) Se decresce a pressão parcial do gás oxigênio na atmosfera e se aumentar a temperatura da água, aumenta o nível de gás oxigênio diluído na água.
b) se decresce a pressão parcial do gás oxigênio na atmosfera e se aumentar a temperatura da água, decresce o nível de gás oxigênio diluído na água.
c) se a pressão parcial do gás oxigênio na atmosfera é normal e se diminuir a temperatura da água, decresce o nível de gás oxigênio diluído na água.
d) se aumentar a pressão atmosférica ambiente e se aumentar a temperatura da água além do limite normal, aumenta o nível de gás oxigênio diluído na água.
e) a pressão parcial do gás oxigênio na atmosfera e o aumento da temperatura da água, não tem nada a ver com o nível de gás oxigênio diluído na água.
4) As orígens naturais do SO2, são os vulcões em atividade, podemos citar ainda outra fonte importante desse poluente ambiental, que são liberados como aerossois marinhos, que da água ganham a atmosfera na forma de sulfato SO42-, outro meio de emissão é feito ainda por espécies bacterianas (orígem biogênica) que metabolizam os compostos com enxofre que acabam sendo liberados para a atmosfera. Os veículos automotores possuem catalisadores metálicos que praticamente elimina a emissão do enxofre (S) para a atmosfera.
Já a orígem antropogênica se dá pela queima de combustíveis fósseis com enxofre, como o diesel, o carvão usado em usinas termelétricas, e a queima do petróleo bruto em muitas industrias produtoras de energia, ou produtoras de cimento, de fundição, e de metalurgia.
Com base nessas afirmações podemos dizer que esse poluente causa no ser humano:
a) problemas nos ossos, cartilagens, e musculatura esquelética, com produção de lactato, levando a sintomas de dores por todo corpo, interfere no processo normal do corpo em geral.
b) problemas econômicos, por causa da produção de compostos nocivos para o meio ambiente causando aumento da temperatura global com aumento de concentração de umidade excessiva na atmosfera provocando enchentes catastróficas.
c) problemas respiratórios, com irritação do sistema respiratório superior, com produção de muco, levando a sintomas de asma, interfere no processo normal do sistema cardiovascular e prejudica ainda mais as pessoas com problemas cardiovasculares.
d) problemas digestivos, com irritação da mucosa intestinal provocando diarreias, fraquezas e mal estar em geral, além da produção de gases em excesso. Ocorre também a produção de muco nos pulmões, levando a tosses, sintomas de falta de ar bronquites e asma.
e) problemas na flora e fauna por causa do desequilíbrio ambiental causado pela chuva ácida, acidificação do solo e da água dos rios e lagos, diminuindo a produção de alimentos que atinge diretamente os seres humanos provocando a escassez de alimentos.
5) O mercúrio é um metal pesado, líquido, cujo ponto de fusão é de -38,9 ºC, é muito tóxico, pode ser aspirado ou ingerido, acumula-se nos órgãos e no sistema nervoso, pode levar à perda de memória, à vida vegetativa ou até à morte, no organismo em geral pode causar, diarreia, tremores, depressão, ansiedade. Numa amostra de água potável coletada, a análise revelou 5,0 . 10-4 mg de mercúrio (Hg) por grama da água. Sendo esse o limite máximo permitido na água para consumo humano, assinale o valor expresso em ppm.
a) 0,05 ppm.
b) 5,0 ppm.
c) 1,1 ppm.
d) 0,5 ppm.
e) 0,15 ppm.
Bibliografia
Oxigênio dissolvido: propriedades e solubilidade - QNEsc
www.qnesc.sbq.org.br/online/qnesc22/a02.pdf
João Usberco e Edgard Salvador - Química - Físico-Química, Volume 2, Editora Saraiva 1º edição - 1995.
João Usberco e Edgard Salvador - Química - Físico-Química, Volume 2, Editora Saraiva 1º edição - 1995.
Poluentes - Fontes e Efeitos - FEPAM - Fundação Estadual ...
www.fepam.rs.gov.br/qualidade/poluentes.as
Atmosphericchemistryofsulfur(IV): emissions, aqueous...
www.scielo.br/scielo.php?script=sci_arttext&pid=S0100...
Wildson Luiz, Gerson de Souza, Roseli Takako, Siland Meiry, Eliane Nilvana, Gentil de Souza, Sandra Maria, Salvia Barbosa Farias. Química & Sociedade, Ensino Médio - Volume único,1ª edição, Editora Nova Geração - São Paulo 2008
Wildson Luiz, Gerson de Souza, Roseli Takako, Siland Meiry, Eliane Nilvana, Gentil de Souza, Sandra Maria, Salvia Barbosa Farias. Química & Sociedade, Ensino Médio - Volume único,1ª edição, Editora Nova Geração - São Paulo 2008
http://ar.cetesb.sp.gov.br/wpcontent/uploads/sites/37/2013/12/relatorio-op-inverno-2013.pdfar.cetesb.sp.gov.br
loading...
- Oxidos
A Definição Para os Óxidos Óxido são substâncias formadas pelo elemento químico oxigênio que é o mais eletronegativo presente em sua estrutura molecular e qualquer outro elemento químico que seja diferente do flúor, pois o flúor possui...
- Questões Sobre Gases E Cinética Química
Primeiro...
- Avaliação - Caderno Do Aluno - Química, Volume 1, 2ª Série
Avaliação Questões Para o 2° Ano...
- A Água E As Suas Propriedades
Quais São as Propriedades da Água? A Temperatura de Ebulição Uma das propriedades da água pura é entrar em ebulição a zero metro de altitude e pressão de uma atmosfera a 100 ºC (graus Celsius). A Temperatura de Fusão Outra...
- Poluição Do Ar
Bolsista: Monika Vapores diferentes. O ar atmosférico é basicamente composto por oxigênio (21%), nitrogênio (78%), gás O ar da atmosfera, fina camada gasosa que envolve a Terra, é uma mistura de muitos tipos de gases e carbônico (0,03%) e mais...
