Química
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- Os Prós E Os Contras Da Menor Densidade Do Gelo
Dissemos há dias que a água sólida (gelo) é menos densa que a água líquida e que portanto uma pedra de gelo num copo de água vem sempre ao de cima. Em termos da natureza isto tem os seus prós e os seus contras. Por um lado, o facto do gelo...
- A Saturação E O Estado De Espírito... Desculpem! O Estado Físico...
As moléculas de qualquer substância atraem-se umas às outras. No estado sólido elas encontram-se próximas e formam ligações entre si. Mas quando se fornece energia (aquecendo), essas ligações podem quebrar-se, as moléculas afastam-se e a substância...
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Densidade...os Prós E Os Contras Da Menor Densidade Do Gelo
Dissemos há dias que a água sólida (gelo) é menos densa que a água líquida e que portanto uma pedra de gelo num copo de água vem sempre ao de cima. Em termos da natureza isto tem os seus prós e os seus contras. Por um lado, o facto do gelo...
Química
Um comportamento pouco normal!
3. O gelo e o seu estranho comportamento

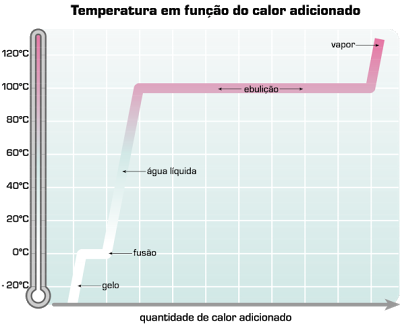
Observando o gráfico, pode ver-se que se tivermos água a uma temperatura inferior a 0oC, ela se encontra no estado sólido (gelo). Se lhe fornecermos calor (energia), a sua temperatura vai aumentando, até se atingir os 0oC. Chegando a este ponto, e durante um certo tempo, mesmo continuando a aquecer, a temperatura não aumenta, mantendo-se constante. Isto acontece porque a energia fornecida vai ser usada para quebrar as ligações que existem entre as moléculas no estado sólido e para as separar, ou seja, é usada para efectuar a mudança de estado de sólido a líquido.
Já reparou que o gelo é menos denso do que a água, e que por isso flutua em água líquida? É um comportamento muito fora do vulgar.

De facto, os sólidos são geralmente mais densos do que os líquidos dos quais provêm. Porquê? Porque quanto mais baixas são as temperaturas, menor é a agitação térmica das moléculas, mais fortes e duradouras são as ligações entre elas e mais próximas ficam. Daí que existam mais moléculas por unidade de volume e, portanto, maior será a densidade. Assim, a parte sólida em contacto com o líquido vai ao fundo.
Ora com a água acontecem coisas mesmo ?esquisitas?: à medida que a sua temperatura baixa até aos 4oC , aumenta, de facto, a sua densidade, mas se continuar a baixar, a densidade baixa de novo. Assim os 4oC são a temperatura a que a água é mais densa. Acima ou abaixo dela a densidade é inferior.
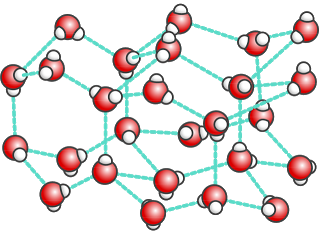
O facto de a água no estado sólido ser menos densa do que a água no estado líquido é explicado pelo tipo de ligações entre as moléculas de água que ocorrem quando esta solidifica ? as ligações de hidrogénio. Estas mantêm as moléculas de água a uma certa distância umas das outras. Forma-se uma estrutura rígida com ligações relativamente fortes entre as moléculas, mas pouco compacta, com muitos espaços no meio.

.
Já aconteceu a quase toda a gente meter uma garrafa com água, bem cheiinha, no congelador e, ao tentar tirá-la, descobrir que ela rebentou. Pudera!, é que a água aumentou mesmo de volume, e a garrafa não conseguiu aguentar a pressão.
loading...
- As Importantíssimas Ligações De Hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.Tal como o nome indica, quando...
- Os Prós E Os Contras Da Menor Densidade Do Gelo
Dissemos há dias que a água sólida (gelo) é menos densa que a água líquida e que portanto uma pedra de gelo num copo de água vem sempre ao de cima. Em termos da natureza isto tem os seus prós e os seus contras. Por um lado, o facto do gelo...
- A Saturação E O Estado De Espírito... Desculpem! O Estado Físico...
As moléculas de qualquer substância atraem-se umas às outras. No estado sólido elas encontram-se próximas e formam ligações entre si. Mas quando se fornece energia (aquecendo), essas ligações podem quebrar-se, as moléculas afastam-se e a substância...
- Água
http://meumundosustentavel.com/noticias/blog-action-day-2010-agua/Todos a conhecemos, faz parte de nós, existe à nossa volta e é tão comum nas nossas vidas que até nos esquecemos da sua importância: a ÁGUA.A molécula de água (H2O) é simples...
- Densidade...os Prós E Os Contras Da Menor Densidade Do Gelo
Dissemos há dias que a água sólida (gelo) é menos densa que a água líquida e que portanto uma pedra de gelo num copo de água vem sempre ao de cima. Em termos da natureza isto tem os seus prós e os seus contras. Por um lado, o facto do gelo...
