Química
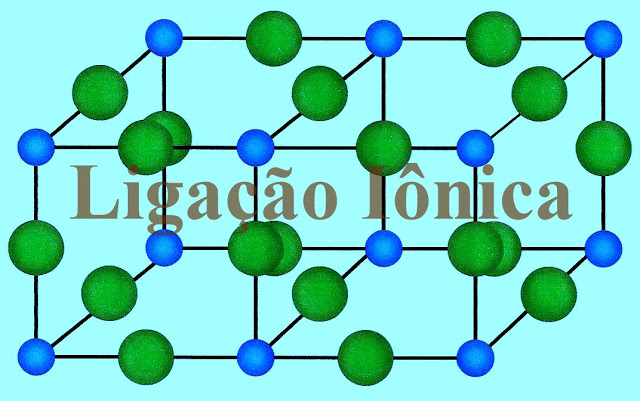 A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron. A diferença da eletronegatividade entre os dois átomos participantes é muito grande e o composto formado a partir da união dos dois elementos químicos é iônico. Os compostos formados por ligações iônicas se apresentam na forma cristalina, e suas estruturas se apresentam com arranjos geométricos bem definidos. Além disso a força eletrostática aproximam tanto os elementos químicos um do outro que o arranjo sólido formado não permite a mobilidade entre os íons da estrutura. Por isso, essas substâncias possuem pontos de fusão e ebulição altos.
A ligação iônica é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo. A ligação ocorre entre um elemento químico metálico, o que cede o elétron e um não metálico, o que recebe o elétron. A diferença da eletronegatividade entre os dois átomos participantes é muito grande e o composto formado a partir da união dos dois elementos químicos é iônico. Os compostos formados por ligações iônicas se apresentam na forma cristalina, e suas estruturas se apresentam com arranjos geométricos bem definidos. Além disso a força eletrostática aproximam tanto os elementos químicos um do outro que o arranjo sólido formado não permite a mobilidade entre os íons da estrutura. Por isso, essas substâncias possuem pontos de fusão e ebulição altos.


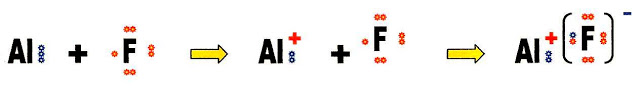


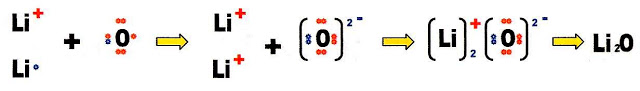

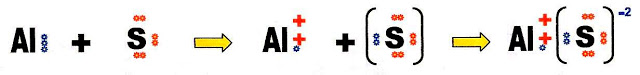
 Bibliografia
Bibliografia
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- Ligação Covalente Dativa
Ligação Covalente Dativa ou Coordenada O Que é Ligação Covalente Dativa? Simplificando a resposta, podemos dizer que ligação covalente dativa é o tipo de ligação em que um dos elementos químicos participantes da molécula em formação,...
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Ligação Iônica
Imagem: http://tomnaquimica.blogspot.com.br/2011/07/ligacoes-ionicas-em-quadrinhos.html Ligação iônicaNormalmente reação química entre metais alcalinos (Li, Na, K) e halogênios (F, Cl) leva a formação de sais que, se dissolvidos em solução...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
Química
Ligação Iônica

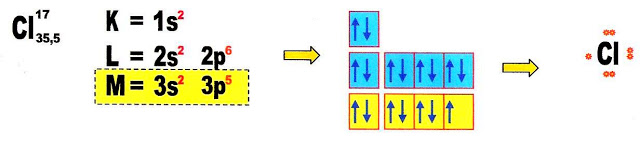
A reação de formação do sal de cozinha (NaCl)
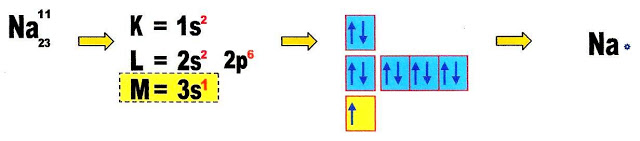
Primeiramente vamos conhecer a valência de seu cátion e de seu ânion, fazendo a distribuição eletrônica de ambos.
Primeiramente vamos conhecer a valência de seu cátion e de seu ânion, fazendo a distribuição eletrônica de ambos.

O cátion sódio (Na) é monovalente possui um elétron na camada de valência, portanto pode "doar" esse elétron.

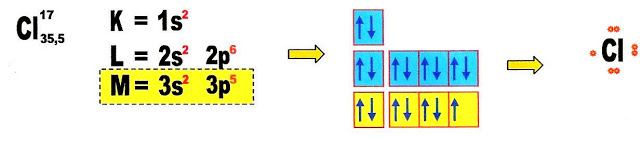
O ânion cloro é monovalente, possui sete elétrons na camada de valência, portanto pode receber um elétron, para completar oito elétrons na camada de valência (teoria do octeto).
Conhecendo a valência de cada átomo, passamos para a ligação química dos mesmos através de suas cargas.

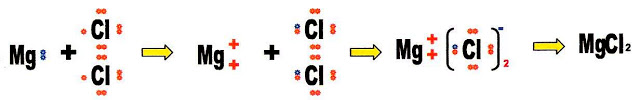
A reação de formação do sal cloreto de magnésio (MgCl2).
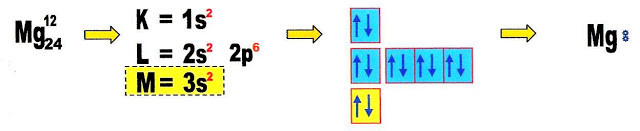
Conhecendo a valência do seu cátion magnésio. Do ânion cloro nós já conhecemos.
O cátion magnésio é bivalente, se combina com dois ânions cloro monovalentes.



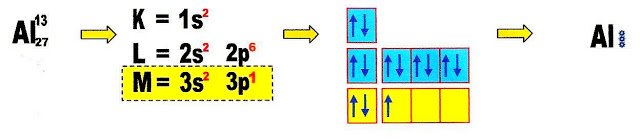
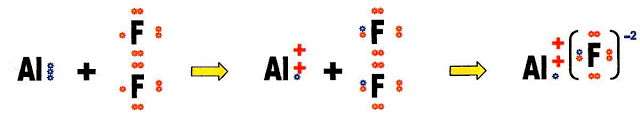
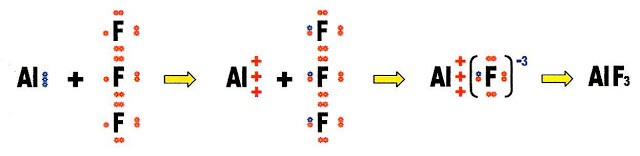
A reação de formação do sal fluoreto de alumínio (AlF3).
Para conhecermos a valência do cátion alumínio e do ânion flúor, fazemos a distribuição eletrônica de ambos.
Para conhecermos a valência do cátion alumínio e do ânion flúor, fazemos a distribuição eletrônica de ambos.

O cátion alumínio é trivalente.

O ânion flúor é monovalente, para equilibrar as cargas positiva e negativa são necessários três átomos de flúor para um alumínio. Vejamos esse equilíbrio passo a passo.
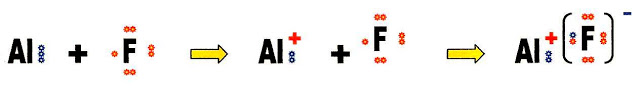


O AlF3 é um composto que pode aparecer na natureza, mas também é preparado sinteticamente. Uma das formas que o fluoreto de alumínio pode ser produzido é na preparação do alumínio, quando se adiciona o ácido hexafluorsilícico à bauxita, o resultado da reação é a geração do fluoreto de alumínio, óxido de silício e água. Preparado na forma de cristal sólido, é insolúvel em água, dissolve-se somente em solvente orgânico, na forma cristalizada é usado como coadjuvante de fusão na eletrólise do alumínio.Também é empregado na esmaltagem de cerâmicas, ajudando a derreter o esmalte, usado para recobrir as peças.
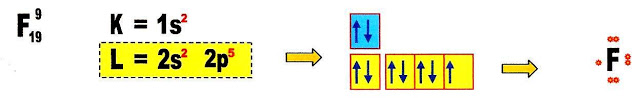
A formação do óxido de lítio.
Fazendo a distribuição eletrônica do átomo de lítio, sabemos que na sua camada de valência há um elétron disponível.

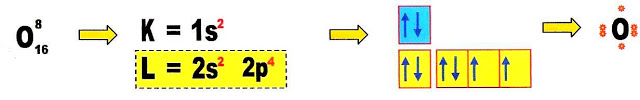
Fazendo a distribuição eletrônica do átomo de oxigênio, ficamos sabendo que esse átomo possui dois orbitais semi-preenchidos e portanto necessita de dois elétrons para preenche-los.

Juntando um átomo de lítio monovalente, com um átomo de oxigênio bivalente, temos uma formação incompleta.

Juntando dois átomos de lítio monovalentes, com um átomo de oxigênio bivalente, temos uma formação completa do composto final.
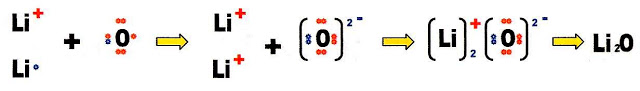
O óxido de lítio (Li2O) é um composto inorgânico que pode ser formado na combustão do lítio metálico que se combina com o oxigênio do ar. Também pode ser produzido a partir da decomposição térmica do peróxido de lítio (Li2O2). Tem a sua aplicação na produção de vidro e também na cerâmica vitrificada.
Tem o seu uso na produção de espumas cerâmicas.
Tem o seu uso na produção de espumas cerâmicas.
No andamento do processo da produção de vidro é adicionado o Li2O que diminui a temperatura de fusão do material que é de aproximadamente 1700 ºC para aproximadamente 1000ºC de temperatura, o que favorece a obtenção de vidro líquido a uma temperatura mais baixa com um clareamento maior desse produto final.
A aplicabilidade se estende na produção de espumas cerâmicas; de cerâmicas celulares, com elevada porosidade que são usadas para isolamento térmico, ou que servem como filtros para metais fundidos. Essas espumas celulares tem a sua utilidade também integrada no complexo dos motores a diesel, no suporte de certos catalisadores e mais recentemente tem ainda o seu uso na área eletrônica e biomédica.
O óxido de lítio reage com o cobre e forma o pigmento de cor azul, e ao se juntar com o cobalto forma o pigmento de cor rosa.
Na Produção de uma base alcalina, o óxido de lítio reage com vapor de água formando hidróxido de lítio (LiOH) (o óxido de lítio deve ser armazenado em ambiente seco).
A formação do sulfeto de alumínio.
Fazendo a distribuição eletrônica do átomo de enxofre para conhecermos a sua camada de valência e a disposição dos elétrons dessa camada.
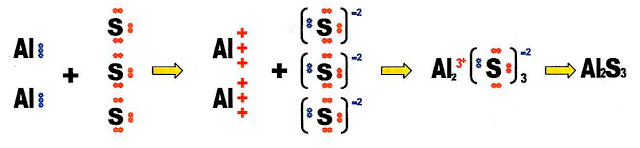
A formação do sulfeto de alumínio.
Fazendo a distribuição eletrônica do átomo de enxofre para conhecermos a sua camada de valência e a disposição dos elétrons dessa camada.

O átomo de enxofre possui seis elétrons na sua camada de valência portanto tem dois orbitais com apenas um elétron cada, necessita de mais dois elétrons para completar esses dois orbitais que estão semi-preenchidos.
Um átomo de alumínio com três elétrons na sua camada de valência, combinando com um átomo de enxofre, que necessita de apenas dois elétrons para completar seus orbitais, resulta na forma incompleta do composto.
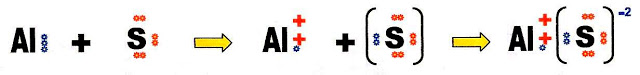
Então, dois átomos de alumínio com três elétrons disponíveis cada, combinando com três átomos de enxofre necessitando de dois elétrons cada, resulta na forma completa do composto final, sulfeto de alumínio.

Exercícios
1) Sobre ligação iônica podemos dizer que
a) é o tipo de ligação em que os átomos compartilham, ou usam emprestado o par de elétrons entre si.:
b) é o tipo de ligação em que um dos átomos transfere, pares de elétrons definitivamente para outro átomo.
c) é o tipo de ligação em que os átomos participantes usam o elétron em comum, temporariamente.
d) é o tipo de ligação em que os átomos se ligam entre si, por pontes de hidrogênio formando ligações fortes.
e) é o tipo de ligação em que um dos átomos transfere, ou entrega o elétron definitivamente para outro átomo.
2) A diferença da eletronegatividade entre os dois átomos participantes da ligação iônica é:
a) muito grande e o composto formado a partir da união dos dois elementos químicos é iônico.
b) muito pequena e o composto formado a partir da união dos dois elementos químicos é covalente molecular normal.
c) não existe e o composto formado a partir da união dos dois elementos químicos são formados unidos por ligações covalentes dativas.
d) muito extensa e o composto formado a partir da união dos demais elementos químicos é iônico.
e) equivalente e o composto formado a partir da união dos dois elementos químicos é insolúvel.
3) . A ligação iônica ocorre:
a) entre um elemento químico gasoso, o que cede o elétron e o não gasoso o que recebe o elétron.
b) entre um elemento químico não metálico, o que cede o elétron e o metálico o que recebe o elétron.
c) entre um elemento químico metálico, o que recebe o elétron e o não metálico o que cede o elétron.
d) entre um elemento químico do grupo dos haletos, o que cede o elétron e o do grupo dos calcogênioso que recebe o elétron.
e) entre um elemento químico metálico, o que cede o elétron e um gasoso o que recebe o elétron.
4) Observe a estrutura cristalina abaixo:
Essa estrutura representa ligações:
a) covalente molecular normal.
b) iônica.
c) metálica.
d) covalente dativa.
e) por pontes de hidrogênio.
Química - química geral - Ricardo Feltre. Editora Moderna, 2007. Volume 1, p.137 a 140.
Cerâmica - Li2O-ZrO2-SiO2 -Al2O3 glass-ceramic foams produced ...
[PDF] Cerâmica - Li2O-ZrO2-SiO2 -Al2O3 glass-ceramic foams produced ...
Espumas vítreas do sistema Li2O-ZrO2-SiO2-Al2O3 produzidas ...
www.scielo.br/pdf/ce/v55n334/07.pdf
loading...
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- Ligação Covalente Dativa
Ligação Covalente Dativa ou Coordenada O Que é Ligação Covalente Dativa? Simplificando a resposta, podemos dizer que ligação covalente dativa é o tipo de ligação em que um dos elementos químicos participantes da molécula em formação,...
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Ligação Iônica
Imagem: http://tomnaquimica.blogspot.com.br/2011/07/ligacoes-ionicas-em-quadrinhos.html Ligação iônicaNormalmente reação química entre metais alcalinos (Li, Na, K) e halogênios (F, Cl) leva a formação de sais que, se dissolvidos em solução...
- Exercícios De Química Geral
01. (PUC-SP) A ligação química entre o elemento de número atômico 19 é o tipo: a) Iônica b) Covalente c) Dativa d) Metálica e) Van der Waals 02. (CESGRANRIO) Identifique, entre os compostos mencionados...
