Química


O Orbital

Química Ensinada reforça a teoria com mais imagens:


Um grande abraço!
Química Ensinada faz a solicitação de que os participantes postem comentários para as aulas do blog Química Ensinada. É uma forma de avaliação do site. Participem sempre. Química Ensinada, agradece.
- A Origem Dos Nomes Dos Orbitais S, P, D E F
A Origem dos nomes dos orbitais s, p, d e fEm 1937 o físico britânico A. C. Candler dividiu a história da espectroscopia em quatro períodos: acústico, das séries, quântico antigo e da mecânica quântica. O primeiro período iniciou com as medidas...
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Números Quânticos
Quais as estratégias de trabalho para que realmente os alunos compreendam o significado dos Números Quânticos? Quando trabalho esse contéudo, percebo a dificuldade dos alunos no entendimento desse assunto. A análise microscópica não é possível,...
- Atividade De Quimica N° 01 Números Quânticos E Diagrama De Pauling
ColégioEstadual............................................................................ Data............/........../........................... Nome:..................................................................................................................
Química
Números Quânticos ? Teoria e exercícios resolvidos.
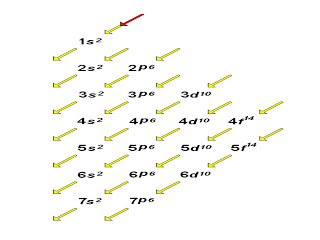
O aluno deve estar atento a alguns pontos: sabendo da complexidade das teorias e modelos atômicos e levando em consideração o modelo atômico atual, é importante lembrar que em qualquer átomo, cada estrutura elétrica chamada de elétron, não deve ser somente caracterizada pelas suas camadas eletrônicas ou número quântico principal que indica o nível de energia, como era mencionado no modelo de Bohr, mas por um conjunto de números quânticos.

O Orbital
O físico austríaco Erwin Schrödinger conseguiu adaptar ao elétron certas equações de movimento de ondas em coordenadas cartesianas. Essas equações matemáticas determinam as regiões do espaço, onde exista a máxima probabilidade de encontrarmos um elétron. Este local ficou conhecido como orbital.
Já foram calculadas quatro formas de orbitais:
Orbital s
Orbital p
Orbital d
Orbital f
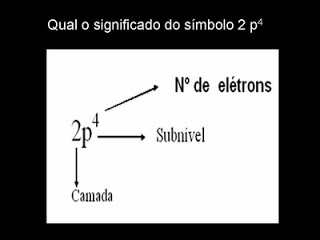
Subnível de energia
È o nome dado a um grupo de orbitais de mesma forma e tamanho, porém em posições espaciais diferentes.
Subnível | Orbitais |
s | 1 orbital s |
p | 3 orbitais p |
d | 5 orbitais d |
f | 7 orbitais f |
Número Quântico Principal (n)
Camadas | K | L | M | N | O | P | Q |
Número Quântico principal ( n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
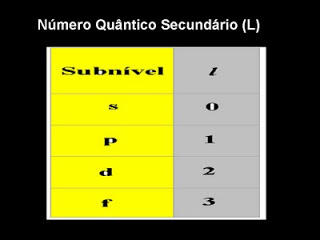
Número Quântico do momentum angular orbital em outros momentos chamado também de número quântico secundário e (azimutal) representado por (l).
l = 0 orbital s
l = 1 orbital p
l = 2 orbital d
l = 3 orbital f
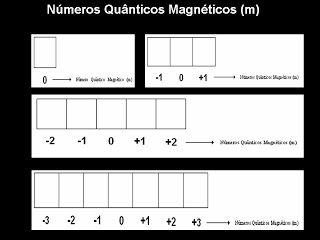
Número Quântico Magnético (m) indica o orbital individual em que um determinado elétron se encontra em um subnível de energia.
Descreve a oientação do orbital no espaço. Número m pode ter qualquer valor entre + l e ? l, inclusive zero.
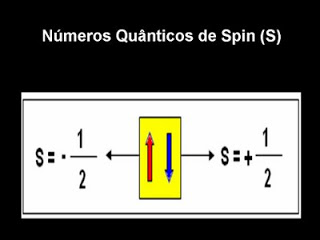
Número Quântico spin (S)
Descreve a rotação do elétron em torno do seu eixo. Pode assumir os valores +1/2 e -1/2.
Dois elétrons de um mesmo orbital apresentam os três primeiros números quânticos iguais, mas possuem spins opostos. Portanto, de acordo com o princípio de exclusão de Pauli é um princípio da Mecânica Quântica formulada em 1925 por Wolfgang Pauli. Dois elétrons de um mesmo átomo nunca podem ter os mesmos quatro números quânticos.
Química Ensinada resolve alguns exercícios com o tema Números Quânticos.
Química Ensinada reforça a teoria com mais imagens:
Um grande abraço!

Química Ensinada faz a solicitação de que os participantes postem comentários para as aulas do blog Química Ensinada. É uma forma de avaliação do site. Participem sempre. Química Ensinada, agradece.
Prof. Ronaldo
loading...
- A Origem Dos Nomes Dos Orbitais S, P, D E F
A Origem dos nomes dos orbitais s, p, d e fEm 1937 o físico britânico A. C. Candler dividiu a história da espectroscopia em quatro períodos: acústico, das séries, quântico antigo e da mecânica quântica. O primeiro período iniciou com as medidas...
- Ligação Covalente Molecular Normal
Ligações Covalentes As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos...
- A Distribuição Eletrônica
A Distribuição Eletrônica Distribuição...
- Números Quânticos
Quais as estratégias de trabalho para que realmente os alunos compreendam o significado dos Números Quânticos? Quando trabalho esse contéudo, percebo a dificuldade dos alunos no entendimento desse assunto. A análise microscópica não é possível,...
- Atividade De Quimica N° 01 Números Quânticos E Diagrama De Pauling
ColégioEstadual............................................................................ Data............/........../........................... Nome:..................................................................................................................
