Química

o lítio é o flúor é o lítio é o flúor é
Pilha de Daniel - pilha de solução salina - pilha de zinco e cobre.
A Pilha de Mercúrio e Zinco
A reação da pilha de mercúrio e zinco é a seguinte:
Pilha de Níquel e Cádmio.
Pilha de Prata e Cobre.
A reação da pilha de prata e cobre é a seguinte:
A Pilha de Leclanché
Reação de oxidação do zinco

Reação de redução do manganês

- Pilhas E Baterias: Uma Oxidação útil
Bateria de níquel-cádmio: presente em telefones.Pilhas e baterias são dispositivos nos quais uma reação espontânea de oxirredução produz corrente elétrica. Não é apropriado saber sobre a aplicação dos vários tipos de pilhas e baterias...
- Eletrólise
Eletrólise Eletrólise A eletrólise de um modo geral é caracterizada por ser um processo de oxirredução ou de obtenção de íons livres com...
- Metais Pesados
Bolsista Luzia M. dos Santos Olá amigos do blog, hoje vamos falar dos elementos químicos metálicos, especificamente dos metais pesados.Mas afinal o que é um metal pesado?O termo metal pesado é utilizado para os metais que possuem densidade superior...
- Se A Vida Te Der Limões Faça Uma Pilha!
Bolsista:Marielle Toledo Silva Que tal aprenderfazer uma pilha bem legal,utilizando apenas limões, fios de cobre e parafusos é só seguir os passos abaixo: Pilha de limão Figura1: Imagem de um sistema para montagem da pilha de limão...
- Origem Das Pilhas
Bolsista: Walmira Gomes Olá galera do QUIPIBID! Vocês sabiam que a história das pilhas começou em uma situação acidental? Inicialmente envolvendo Luigi Galvani, mas quem de fato explicou corretamente a sua origem...
Química
Pilhas
Pilhas
Conceitos Básicos de Eletricidade
O Elétron
As pilhas são produtoras de eletricidade a partir de uma transformação química.
Pilhas - Oxidação e Redução
A reação que acontece em uma pilha é de oxidação e redução. A oxidação é a perda de elétrons e a redução é o ganho de elétrons. Na pilha portanto ocorre a reação simultânea de oxi-redução.
Exemplos de Oxidantes e Redutores
Pilha de Zinco e Cobre
A reação de oxidação e redução que acontece na pilha de Daniel é a seguinte:

zinco é o o cobre é o o zinco é o o cobre é o
redutor oxidante oxidado reduzido
ânodo cátodo
Pilha de Zinco e Chumbo
A reação de oxidação e redução que acontece na pilha de zinco e chumbo é a seguinte:

Pilha de Lítio e Flúor
A reação de oxidação e redução que acontece na pilha de lítio e flúor é a seguinte:
Conceitos Básicos de Eletricidade
O Elétron
O elétron por definição simplificada, é a partícula de carga negativa que gira a uma velocidade próxima a da luz, em torno do núcleo positivo do átomo formando um campo elétrico e magnético. Já em 1897 J.J Thomson descreve o elétron como uma sub-partícula atômica de carga negativa.
A física enquadra o elétron no padrão das sub-partículas; da família dos léptons, que são; o múon uma outra partícula de carga negativa, (existe também múon de carga neutra) e o tau também possui carga elétrica negativa e os neutrinos que são sub-partículas de carga elétrica neutra, esses dois últimos como o elétron também são férmions.
A Carga de um Elétron
A massa de um elétron corresponde a 1/1836,15 a massa de um próton, que pode também corresponder a 9,109 x 10-31 kg, cuja carga, de apenas um elétron é de 1,609 x 10-19 C.
Coulomb (C)
PilhasO Coulomb de símbolo C, corresponde a quantidade de carga que forma uma corrente elétrica de um Ampére, que passa por um condutor durante um segundo. O Coulomb é a quantidade de carga que corresponde a 6,25 x 1018 elétrons que passa por um determinado ponto de um condutor durante um segundo.
Ampére
O Ampére nome dado em homenagem a André-Marie Ampére, cujo simbolo é A, é uma unidade básica de indicação da corrente elétrica. Um Ampére é a corrente elétrica de 1 Coulomb que possui carga de 6,28 x 1018 elétrons que passa por determinado ponto do condutor por um segundo.
O Volt
O volt, de Alexandro Volta, tem por simbolo V é a unidade de medida da tensão elétrica de transmissão de energia em Joules, que corresponde a carga de um Coulomb que corresponde a carga de um ampere, cujo número de elétrons que passa por um ponto determinado é de 6,25 x 1018. O volt também pode ser definido como a diferença de potencial de uma corrente elétrica que atravessa um condutor com a corrente de um ampere que se dissipa em energia de trabalho.
Faraday
O Faraday nome dado em intenção á Michael Faraday é utilizado em galvanização e a sua primeira lei diz que, a massa da substância utilizada na eletrólise é proporcional a quantidade de eletricidade aplicada que passa pela solução eletrolítica.
A sua segunda lei diz que se uma mesma quantidade de energia elétrica atravessar vários eletrólitos, as massas das espécies químicas puras obtidas é proporcional ao equivalente de cada substância.
Um Faraday corresponde a 96500 Coulombs.
Portanto podemos equacionar a primeira lei de Faraday sendo; m = K2 x E.
E a segunda lei de Faraday sendo; m = E x i x t.
Onde m = massa do metal que se quer obter na eletrólise.
E = é o equivalente-grama da substância a sofrer eletrólise.
k = i = intensidade da corrente elétrica em Ampere.
t = tempo em segundo.
(Ver isso em eletrólise).
Exercícios Resolvidos
1) Sabendo que a carga de apenas um elétron corresponde a 1,603 x 10-19 C, quais serão as cargas em Coulomb correspondentes aos seguintes números de elétrons .
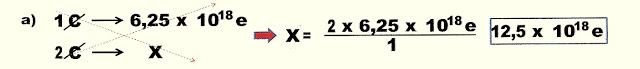
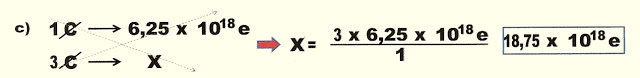
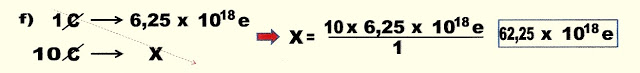
Materiais Condutores de Eletricidade
Ampére
O Ampére nome dado em homenagem a André-Marie Ampére, cujo simbolo é A, é uma unidade básica de indicação da corrente elétrica. Um Ampére é a corrente elétrica de 1 Coulomb que possui carga de 6,28 x 1018 elétrons que passa por determinado ponto do condutor por um segundo.
Para corrente elétrica de baixa amperagem utilizamos o miliampere (mA) e o microampere (?A).
O Volt
O volt, de Alexandro Volta, tem por simbolo V é a unidade de medida da tensão elétrica de transmissão de energia em Joules, que corresponde a carga de um Coulomb que corresponde a carga de um ampere, cujo número de elétrons que passa por um ponto determinado é de 6,25 x 1018. O volt também pode ser definido como a diferença de potencial de uma corrente elétrica que atravessa um condutor com a corrente de um ampere que se dissipa em energia de trabalho.
Faraday
O Faraday nome dado em intenção á Michael Faraday é utilizado em galvanização e a sua primeira lei diz que, a massa da substância utilizada na eletrólise é proporcional a quantidade de eletricidade aplicada que passa pela solução eletrolítica.
A sua segunda lei diz que se uma mesma quantidade de energia elétrica atravessar vários eletrólitos, as massas das espécies químicas puras obtidas é proporcional ao equivalente de cada substância.
Um Faraday corresponde a 96500 Coulombs.
Portanto podemos equacionar a primeira lei de Faraday sendo; m = K2 x E.
E a segunda lei de Faraday sendo; m = E x i x t.
Onde m = massa do metal que se quer obter na eletrólise.
E = é o equivalente-grama da substância a sofrer eletrólise.
k = i = intensidade da corrente elétrica em Ampere.
t = tempo em segundo.
(Ver isso em eletrólise).
Exercícios Resolvidos
1) Sabendo que a carga de apenas um elétron corresponde a 1,603 x 10-19 C, quais serão as cargas em Coulomb correspondentes aos seguintes números de elétrons .
a) | 1 elétron | = | 1 x 1,603 x 10- | = | 1,605 x 10- |
b) | 2 elétrons | = | 2 x 1,603 x 10- | = | 3,21 x 10- |
c) | 3 ? | = | 3 x 1,603 x 10- | = | 4,815 x 10- |
d) | 4 ? | = | 4 x 1,603 x 10- | = | 6,42 x 10- |
e) | 5 ? | = | 5 x 1,603 x 10- | = | 8,025 x 10- |
f) | 10 ? | = | 10 x 1,603 x 10- | = | 16,05 x 10- |
g) | 20 ? | = | 20 x 1,603 x 10- | = | 32,10 x 10- |
h) | 50 ? | = | 50 x 1,603 x 10- | = | 80,25 x 10- |
i) | 100 ? | = | 100 x 1,603 x 10- | = | 160,50 x 10- |
j) | 1000 ? | = | 1000 x 1,603 x 10- | = | 1605,00 x 10- |
k) | 104 ? | = | 104 x 1,603 x 10- | = | 1,605 x 10- |
l) | 106 ? | = | 106 x 1,603 x 10- | = | 1,605 x 10- |
m) | 109 ? | = | 109 x 1,603 x 10- | = | 1,605 x 10- |
n) | 1012 ? | = | 1012 x 1,603 x 10- | = | 1,605 x 10- |
o) | 1015 ? | = | 1015 x 1,603 x 10- | = | 1,605 x 10- |
p) | 1018 ? | = | 1018 x 1,603 x 10- | = | 1,605 x 10- |
q) | 1021 ? | = | 1021 x 1,603 x 10- | = | 1,605 x |
r) | 1023 " | = | 1023 x 1,603 x 10- | = | 1,605 x |
s) | 1 x 1023 | = | 1 x 1023 x 1,603 x 10- | = | 1,605 x |
t) | 2 x 1023 | = | 2 x 1023 x 1,603 x 10- | = | 3,21 x |
u) | 3 x 1023 | = | 3 x 1023 x 1,603 x 10- | = | 4,815 x |
v) | 4 x 1023 | = | 4 x 1023 x 1,603 x 10- | = | 6,42 x |
x) | 6,02 x 1023 | = | 6,02 x 1023 x 1,603 x 10- | 9,6621 x |
Faça você mesmo os seguintes itens.
2) Calcular o número de elétrons envolvidos nas seguintes cargas em Coulomb (C).
a) 1 C = ..................................................................................................
b) 2 C = ..................................................................................................
c) 3 C = ...................................................................................................
d) 4 C = ..................................................................................................
e) 5 C = ..................................................................................................
f) 10 C = ..................................................................................................
g) 20 C = ...................................................................................................
h) 50 C = ...................................................................................................
i) 100 C = ...................................................................................................
j) 1000 C = ...................................................................................................
k) 1030 C = ...................................................................................................
l) 1100 C = ...................................................................................................
m) 1603 C = ...................................................................................................
n) 16030 C = ...................................................................................................
o) 32180 C = ...................................................................................................
p) 48090 C = ...................................................................................................
q) 64360 C = ...................................................................................................
r) 80450 C = ....................................................................................................
s) 96500C = ....................................................................................................
Resolução
2) Calcular o número de elétrons envolvidos nas seguintes cargas em Coulomb (C).
a) 1 C = ..................................................................................................
b) 2 C = ..................................................................................................
c) 3 C = ...................................................................................................
d) 4 C = ..................................................................................................
e) 5 C = ..................................................................................................
f) 10 C = ..................................................................................................
g) 20 C = ...................................................................................................
h) 50 C = ...................................................................................................
i) 100 C = ...................................................................................................
j) 1000 C = ...................................................................................................
k) 1030 C = ...................................................................................................
l) 1100 C = ...................................................................................................
m) 1603 C = ...................................................................................................
n) 16030 C = ...................................................................................................
o) 32180 C = ...................................................................................................
p) 48090 C = ...................................................................................................
q) 64360 C = ...................................................................................................
r) 80450 C = ....................................................................................................
s) 96500C = ....................................................................................................
Resolução
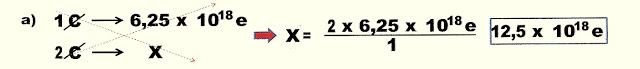
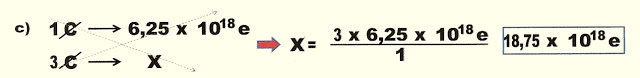
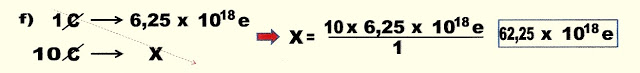
Materiais Condutores de Eletricidade
Os materiais condutores de eletricidade, são aqueles que permitem o fluxo, ou o deslocamento de elétrons livres de um local para outro, especialmente quando podem ser desdobrados em fios.
Os principais materiais condutores de eletricidade são: a prata, o cobre, o ouro, o alumínio, o ferro, tungstênio, zinco, bronze, latão, níquel, platina, estanho.
Soluções salinas também são boas condutoras de eletricidade, a solução de cloreto de sódio (NaCl), cloreto de potássio, (KCl) sulfato de cobre (CuSO4), Sulfato de zinco (ZnSO4) iodeto de potássio (KI).
Soluções ácidas São Boas Condutoras de eletricidade, a solução de ácido sulfúrico (H2SO4) ácido clorídrico (HCl).
Soluções alcalinas - solução de hidróxido de sódio (NaOH), hidróxido de potássio (KOH).
Óxido de chumbo (PbO2) que funciona como cátodo em baterias de carros.
Soluções salinas também são boas condutoras de eletricidade, a solução de cloreto de sódio (NaCl), cloreto de potássio, (KCl) sulfato de cobre (CuSO4), Sulfato de zinco (ZnSO4) iodeto de potássio (KI).
Soluções ácidas São Boas Condutoras de eletricidade, a solução de ácido sulfúrico (H2SO4) ácido clorídrico (HCl).
Soluções alcalinas - solução de hidróxido de sódio (NaOH), hidróxido de potássio (KOH).
Óxido de chumbo (PbO2) que funciona como cátodo em baterias de carros.
Materiais Isolantes de Eletricidade
Os principais materiais isolantes de eletricidade são: o isolante elétrico de cerâmica ou porcelana cujo material primordial é a argila, o plástico comum, o teflon, a baquelite, o vidro, a borracha, a lã, a seda, a mica, o enxofre, a celulose ou a madeira também são isolantes, o óleo tanto o mineral como o comestível, de soja ou de girassol, podem ser isolantes líquidos porque suas partículas possuem átomos com maior estabilidade nas moléculas. Os óleos geralmente são utilizados em reatores de potência, nos capacitores de alta tensão, nas chaves elétricas, é utilizado óleo isolante para dissipar o calor ou isolar a tensão da carga, nos comutadores que são peças de bobinas de rolamento de motores elétricos, estes também podem usar óleos isolantes. Alguns óleos minerais são utilizados como isolantes de transformadores de alta tensão elétrica. A água deionizada pode ser um isolante elétrico.
As pilhas são produtoras de eletricidade a partir de uma transformação química.
Pilhas - Oxidação e Redução
A reação que acontece em uma pilha é de oxidação e redução. A oxidação é a perda de elétrons e a redução é o ganho de elétrons. Na pilha portanto ocorre a reação simultânea de oxi-redução.
Exemplos de Oxidantes e Redutores
Pilha de Zinco e Cobre
A reação de oxidação e redução que acontece na pilha de Daniel é a seguinte:

redutor oxidante oxidado reduzido
ânodo cátodo
Pilha de Zinco e Chumbo
A reação de oxidação e redução que acontece na pilha de zinco e chumbo é a seguinte:

o zinco é o chumbo é o zinco é o chumbo é
o redutor o oxidante oxidado reduzido
ânodo cátodoPilha de Lítio e Flúor
A reação de oxidação e redução que acontece na pilha de lítio e flúor é a seguinte:

o lítio é o flúor é o lítio é o flúor é
o redutor o oxidante oxidado reduzido
ânodo cátodo
A Pilha de Zinco e Níquel

O lítio é o o níquel é o o zinco é o níquel é
redutor oxidante oxidado reduzido
ânodo cátodo
ânodo cátodo
A Pilha de Zinco e Níquel

O lítio é o o níquel é o o zinco é o níquel é
redutor oxidante oxidado reduzido
ânodo cátodo
Os Diversos Tipos de Pilhas
Pilha de Daniel - pilha de solução salina - pilha de zinco e cobre.
A Pilha de Mercúrio e Zinco
A reação da pilha de mercúrio e zinco é a seguinte:
HgO + Zn ? pasta de KOH ? ZnO + Hg ou a reação:
Zn(Hg) + HgO ? pasta de KOH ? Zn(OH)2 + Hg
Pilha de mercúrio - consiste num amalgama de zinco, mercúrio e hidróxido de potássio.
Pilha de Níquel e Cádmio.
A reação da pilha de níquel e cádmio é a seguinte:
Cd(s) + 2 Ni(OH)3(s) ?sol ?KOH ? CdO(s) + 2Ni(OH)2(s) + H2O(l)
Pilha de Prata e Cobre.
Cu(s) + 2 Ag+(aq) ? Cu2+(aq) + 2 Ag(s)
Pilha de Lítio
A pilha de lítio produz uma voltagem maior que as das outras, sua carga é de 3,4 volts e é utilizada em marcapasso cardíaco.
A reação dessa pilha pode ser descrita pela equação:
4 Li + 2 SOCl2 ----------> 4 Li+ + 4 Cl- + S + SO2
ânodo cátodo
Pilhas - Força Eletromotriz
A força eletromotriz é a diferença de energia de oxidação produzida na entre o oxidante e o oxidado, ou seja; é o resultado da diferença de potencial dos eletrodos da pilha, ou ainda, é a facilidade com que um material mais reativo doa elétrons para outro menos reativo.
Vejamos exemplo:
Esquema Básico Para o Funcionamento Das Pilhas em Geral
Pilha de Lítio
A pilha de lítio produz uma voltagem maior que as das outras, sua carga é de 3,4 volts e é utilizada em marcapasso cardíaco.
A reação dessa pilha pode ser descrita pela equação:
4 Li + 2 SOCl2 ----------> 4 Li+ + 4 Cl- + S + SO2
ânodo cátodo
Pilhas - Força Eletromotriz
Força eletromotriz F.E.M. ou é representada pelo simbolo ?E
A força eletromotriz é a diferença de energia de oxidação produzida na entre o oxidante e o oxidado, ou seja; é o resultado da diferença de potencial dos eletrodos da pilha, ou ainda, é a facilidade com que um material mais reativo doa elétrons para outro menos reativo.
Quanto maior a diferença de reatividade entre os metais, maior o ddp, maior será a força eletromotriz gerada.
Concluindo: A F.E.M. é a quantidade de carga líquida que a pilha produz.
Vejamos exemplo:
1) Calcule a força eletromotriz F.E.M. gerada na pilha de zinco e cobre. Consulta-se a tabela de potenciais padrão de eletrodos.
Potencial de oxidação do cobre é - 0,337 = - 0,34
Potencial de oxidação do Zn é + 0,76
F.E.M. = Eoxi do ânodo ? Eoxi do cátodo.
F.E.M. = EoxiZn ? Eoxi Cu
F.E.M. = +0,76 - (- 0,34)
F.E.M. = +0,76 + +0,34 = +1,10 V
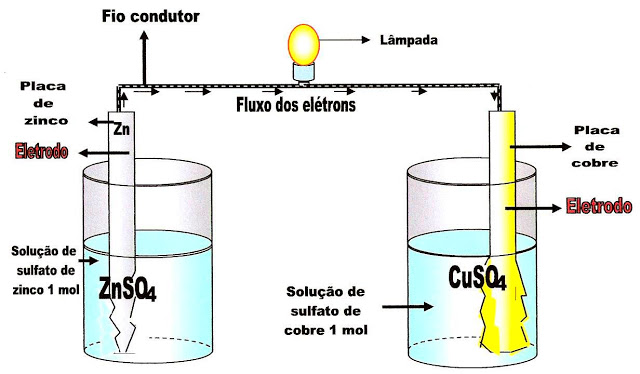
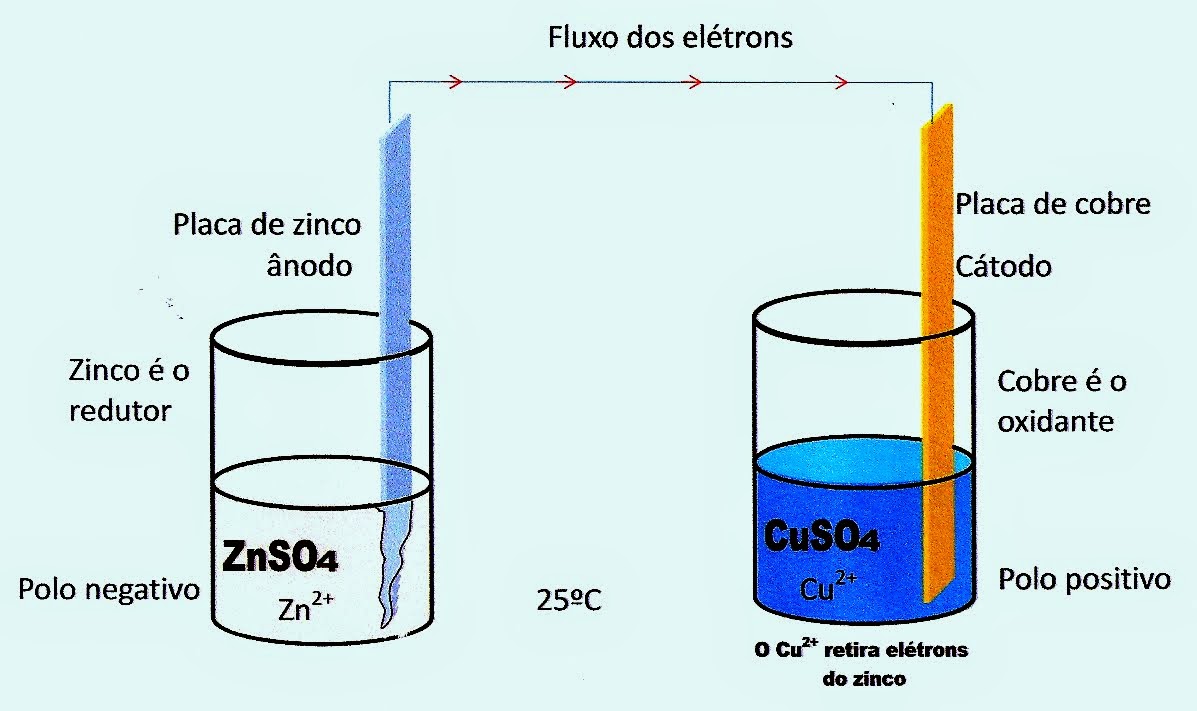
Utilizando o esquema padrão da pilha de Daniel, é possível ter uma noção do processo de funcionamento das pilhas em geral.
Abaixo está representado um recipiente contendo sulfato de zinco (ZnSO4), redutor, com uma placa de zinco (ânodo, polo negativo) mergulhada no seu meio, e outro recipiente com sulfato de cobre (CuSO4), oxidante, com uma placa de cobre (cátodo, polo positivo) mergulhada no seu meio.

A Pilha de Daniel
A pilha de Daniel é montada a partir de dois recipientes, um contendo solução de sulfato de zinco um molar e outro contendo solução de sulfato de cobre um molar.
É colocado na solução de sulfato de zinco uma placa de zinco (eletrodo de zinco) e na solução de sulfato de cobre uma placa de cobre (eletrodo de cobre).
Esses dois eletrodos em recipientes separados, são ligados por um fio condutor que possibilita a passagem da corrente elétrica, ou fluxo de elétrons que saem da solução de sulfato de zinco e vão para a solução de sulfato de cobre.
Eletrodo de Zinco e Solução De Sulfato de Zinco
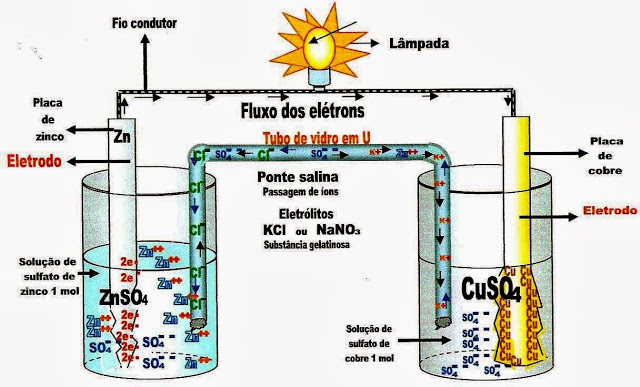
A Ponte Salina
Para que haja movimentação dos elétrons pelo fio condutor por um período mais prolongado, além desse fio condutor metálico, há a necessidade de outro fator, ou seja; da ponte salina, que contém uma solução gelatinosa de cloreto de potássio (KCl) ou ainda pode ser substituida por outra substância o nitrato de sódio (NaNO3).
É essa ponte salina que prolonga a vida da pilha, ou seja aumenta o tempo de circulação dos elétrons pelo fio condutor acima, de um recipiente para outro; do recipiente com sulfato de zinco para o com sulfato de cobre. A ponte salina gelatinosa, tem a função de promover a migração através do gel, do íon potássio K+, para o lado da solução de sulfato de cobre, ou cátodo e do cloro Cl-, para o lado da solução de sulfato de zinco ou ânodo, fortalecendo a diferença de potencial da pilha e mantendo a sua duração.
É colocado na solução de sulfato de zinco uma placa de zinco (eletrodo de zinco) e na solução de sulfato de cobre uma placa de cobre (eletrodo de cobre).
Esses dois eletrodos em recipientes separados, são ligados por um fio condutor que possibilita a passagem da corrente elétrica, ou fluxo de elétrons que saem da solução de sulfato de zinco e vão para a solução de sulfato de cobre.
Eletrodo de Zinco e Solução De Sulfato de Zinco
O eletrodo de zinco mergulhado em solução aquosa de sulfato de zinco (ZnSO4) 1 molar, começa a se desgastar, enquanto o meio vai se tornando cada vez mais ionizado. A partir dai, com o aumento do íon sulfato SO4--livre, vai sendo liberado da placa de zinco cada vez mais Zn++, que ficam como íons ?soltos? ou livres na solução. Os elétrons livres do zinco vão se encaminhando pela placa, depois pelo fio condutor até chegar ao outro recipiente com a placa de cobre.
Eletrodo de Cobre na Solução de Sulfato de Cobre
Na solução aquosa de sulfato de cobre um molar, vai ocorrendo a ionização e liberação dos cátions Cu++ e ânions sulfato SO4? ?no meio aquoso, onde está mergulhada a placa de cobre, ou o chamado eletrodo de cobre.
Com a chegada da corrente elétrica provinda do eletrodo de zinco, a placa ou eletrodo de cobre, com esses elétrons, atrai o cátion cobre Cu++ que migra da solução para esse eletrodo, vai se acumulando na forma de uma massa metálica de cobre reduzido ou cobre metálico (Cuº). Com a continuidade do fluxo de elétrons provindo do eletrodo de zinco para o de cobre, os elétrons nessa placa, atrai mais e mais cobre na forma reduzida, enquanto na solução acumula-se íon sulfato SO4--, que atrai o íon potássio K+ da ponte salina para o seu lado.
A Ponte Salina
Para que haja movimentação dos elétrons pelo fio condutor por um período mais prolongado, além desse fio condutor metálico, há a necessidade de outro fator, ou seja; da ponte salina, que contém uma solução gelatinosa de cloreto de potássio (KCl) ou ainda pode ser substituida por outra substância o nitrato de sódio (NaNO3).
É essa ponte salina que prolonga a vida da pilha, ou seja aumenta o tempo de circulação dos elétrons pelo fio condutor acima, de um recipiente para outro; do recipiente com sulfato de zinco para o com sulfato de cobre. A ponte salina gelatinosa, tem a função de promover a migração através do gel, do íon potássio K+, para o lado da solução de sulfato de cobre, ou cátodo e do cloro Cl-, para o lado da solução de sulfato de zinco ou ânodo, fortalecendo a diferença de potencial da pilha e mantendo a sua duração.


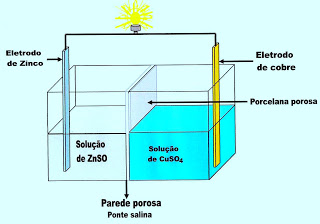
O esquema ao lado representa a mesma pilha de Daniel. Separando as duas soluções de sulfato de cobre e sulfato de zinco, existe uma parede de porcelana porosa que facilita a passagem de íons, mas não deixa que se misturem as soluções propriamente ditas.
Observe que é necessário fechar o circuito com a construção da ponte salina, a qual é constituida de solução gelatinosa de cloreto de potássio (KCl), para ocorrer o fluxo dos elétrons pelo fio condutor, do eletrodo de zinco para o eletrodo de cobre.
Com a corrente elétrica, a lâmpada que está conectada ao fio condutor de elétrons, acende.
A Função da Ponte Salina
A ponte salina é um tubo de vidro em U, com as extremidades fechadas com material poroso ou gelatinoso ou algodão, como um tampo em cada extremidade para que haja seletividade relativa dos meios. A função desse tubo é conduzir (íons) Cl- e K+. O cloro
(Cl-) com carga negativa se dirige para o lado do recipiente com zinco que está na forma de cátion, e o K+ na forma de cátion se dirige para o lado da solução de sulfato de cobre que está cheia de ânions sulfato SO4-- liberados do CuSO4, possibilitando a manutenção da corrente elétrica por mais tempo.
Sem o tubo em U essa pilha não funcionaria, são os cátions e os ânions do meio gelatinoso do tubo que permitem, a fruição da corrente de elétrons que saem do ânodo (haste de zinco) e passam pelo fio condutor e chegam até a placa de cobre, (cátodo) por mais tempo de duração.
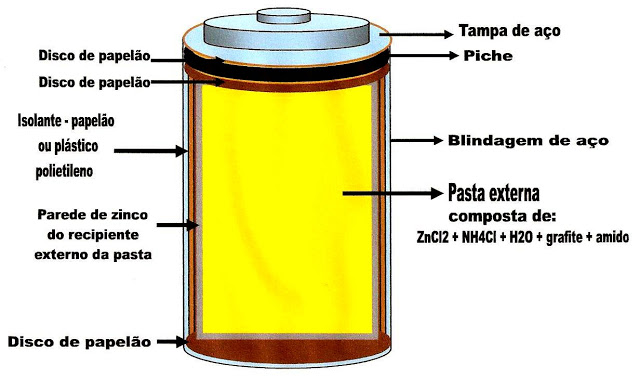
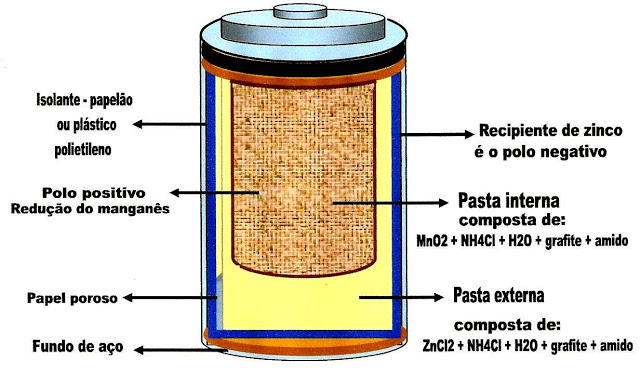
A Pilha de Leclanché
O frances Georges Leclanché é o inventor da pilha seca. Nós usamos nos aparelhos como radios de pilha, lanternas a pilha, relógios de parede, despertadores, controles remotos, brinquedos, etc.
Figura 1- Esquema simplificado da parte externa da pilha de Leclanché, representando a tampa de aço, a blindagem de aço externa do corpo da pilha, os discos de papelão, o concentrado de piche na parte superior, o isolante de plástico polietileno ou papelão, a parede de zinco envolvendo a pasta externa, composta de cloreto de zinco, cloreto de amônia, água, grafite e amido.

Na figura 2 logo abaixo, mostra a massa pastosa interna separada da massa pastosa externa da pilha. A massa interna está num invólucro que a separa da pasta interna e é formada por óxido de manganês, cloreto de amônia, água, grafite e amido.
?

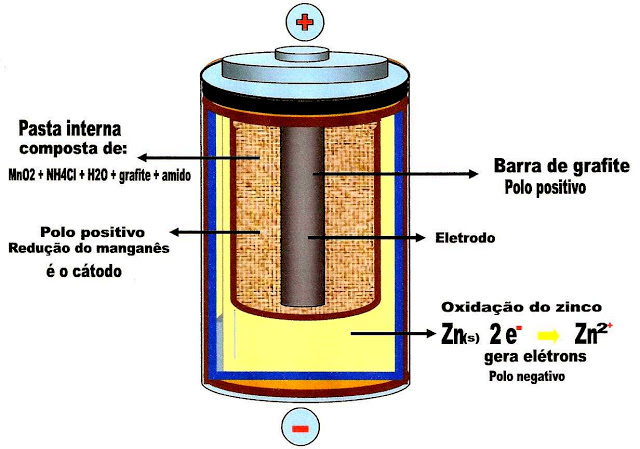
A figura 3 mostra uma barra de grafite no centro da pilha. Essa barra forma o pólo positivo que atrai os elétrons provindos do ânodo ou da pasta externa, e interna.
Reação de oxidação do zinco

Reação de redução do manganês


A figura 4 abaixo, mostra o fluxo dos elétrons que saem da pasta de zinco, passam para a pasta de manganês e depois para a barra de grafite, formando a corrente elétrica.
Obs: as camadas da pasta externa , pasta interna, a barra de grafite descem até a base da pilha.
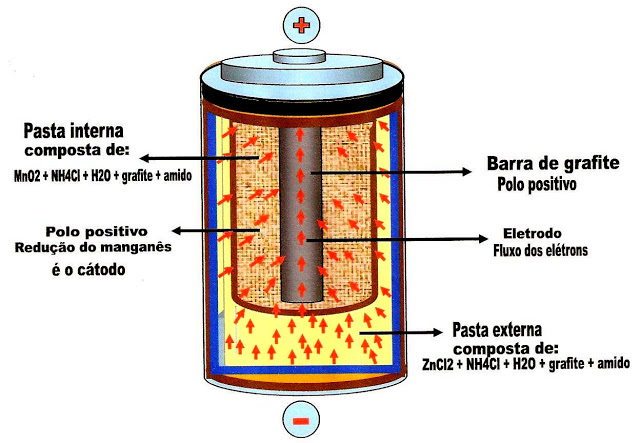
Obs: as camadas da pasta externa , pasta interna, a barra de grafite descem até a base da pilha.

A voltagem produzida por todo o complexo é de 1,5 V.
Exercícios
Assinale apenas uma resposta correta.
Para obter as respostas recorra ao texto acima.
5) A pilha de Leclanché, pilha seca comum que usamos no nosso controle remoto, aparelhos de som portáteis e brinquedos, produz voltagem até:
a) 6,0 volts.
b) 1,0 volt.
c) -0,76 volt.
d) -0,34 volt.
e) 1,5 volt.
Exercícios
1) (Adaptado) Numa pilha em condições padrão, de eletrodo de alumínio e eletrodo de enxofre, cujos potenciais de oxidação é respectivamente: Eoxi = +1,66 e Eoxi = +0,48, pede-se calcular a sua força eletromotriz, F.E.M.
A reação do eletrodo de alumínio é: Al -------------- Al3+ + 3e- Eoxi = +1,66 V.
A reação do eletrodo de enxofre é: S2- -------------- S + 2e- Eoxi = +048 V.
F.E.M. = energia do eletrodo que recebe elétrons ? energia do eletrodo que doa elétrons.
F.E.M. = Eoxi ânodo ? Eoxi cátodo.
F.E.M. = +1,66 ? +0,48
F.E.M. = +1,66 ? 0,48
F.E.M. = +1,18 Volt.
Exercícios SimplificadosAssinale apenas uma resposta correta.
Para obter as respostas recorra ao texto acima.
1) Podemos definir o elétron como:
a) uma sub-partícula com carga negativa, inserida no núcleo atômico, que o torna fonte de energia.
b) um átomo com carga negativa, inserida na sua massa, que o torna uma partícula elétrica.
c) uma sub-partícula atômica de carga negativa inserida no núcleo que neutraliza a carga do próton.
d) uma sub-partícula atômica de carga negativa girando num orbital distante do núcleo.
e) partícula extremamente pequena, esférica, maciça, homogênea, indivisível, indestrutível, e de carga eletricamente neutra.
2) Podemos definir o Coulomb tendo como:
a) símbolo C, e corresponde a quantidade de carga que forma uma corrente elétrica de 1,609 x 10-19 C elétrons, que passa por um condutor durante um milisegundo.
b) símbolo C, e corresponde a quantidade de carga que forma uma corrente elétrica de 6,02 x 1023 elétrons, que passa por um condutor durante um microsegundo.
c) símbolo C, e corresponde a quantidade de carga que forma uma corrente elétrica de 6,25 x 1018 elétrons, que passa por um condutor durante um segundo.
d) símbolo C, e corresponde a quantidade de carga que forma uma corrente elétrica de 96500 elétrons, que passa por um condutor durante uma hora.
e) símbolo C, e corresponde a quantidade de carga que forma uma corrente elétrica de 9,109 x 10-31 elétrons, que passa por um condutor durante uma hora.
3) Sobre o ampere podemos afirmar que:
a) tem por símbolo V é a unidade de medida da tensão elétrica de transmissão de energia em Joules, que corresponde a carga de um Coulomb.
b) homenageia André-Marie Ampére, cujo símbolo é A, é a unidade matemática básica da corrente elétrica que passa por um ponto do condutor em 1 segundo.
c) é utilizado em galvanização e a sua primeira lei diz que, a massa da substância utilizada na eletrólise é proporcional a quantidade de eletricidade aplicada que passa pela solução eletrolítica.
d) corresponde a 1/1836,15 a massa de um próton, que pode também corresponder a
9,109 x 10 -31 kg, cuja carga; de apenas um elétron é de 1,609 x 10-19 C.
9,109 x 10 -31 kg, cuja carga; de apenas um elétron é de 1,609 x 10-19 C.
e) se uma mesma quantidade de energia elétrica atravessar vários eletrólitos, as massas das espécies químicas puras obtidas é proporcional ao equivalente de cada substância.
4) Alguns dos melhores condutores de eletricidade são:
a) plástico comum, borracha, baquelite, vidro, lã.
b) prata, o cobre, o ouro, o alumínio, o ferro, tungstênio.
c) o ar, a água, os gases, os líquidos em geral e os metais.
d) prata, o cobre, o ouro, o alumínio, o ferro, tungstênio e borracha.
4) Alguns dos melhores condutores de eletricidade são:
a) plástico comum, borracha, baquelite, vidro, lã.
b) prata, o cobre, o ouro, o alumínio, o ferro, tungstênio.
c) o ar, a água, os gases, os líquidos em geral e os metais.
d) prata, o cobre, o ouro, o alumínio, o ferro, tungstênio e borracha.
a) 6,0 volts.
b) 1,0 volt.
c) -0,76 volt.
d) -0,34 volt.
e) 1,5 volt.
6) A pilha de Daniel é montada a partir de:
a) três recipientes, um contendo solução de sulfato de zinco um molar, com uma placa de zinco no seu interior e outro contendo solução de sulfato de cobre um molar com uma placa de cobre metálico e outro com solução de cloreto de potássio.
b) dois recipientes, um contendo solução de sulfato de magnésio um molar, com uma placa de zinco metálico no seu interior e outro contendo solução de sulfato de amônia um molar com uma placa de cobre metálico.
c) dois recipientes, um contendo solução de sulfato de zinco um molar, com uma placa de cobre metálico no seu interior e outro contendo solução de sulfato de ferro um molar com uma placa de cobre metálico.
d) dois recipientes, um contendo solução de sulfato de zinco um molar, e uma placa de zinco metálico no seu interior, outro contendo solução de sulfato de cobre um molar com uma placa de cobre metálico, sendo ambas as placas ligadas por um fio condutor.
e) dois recipientes, um contendo solução de sulfato de zinco um molar, com uma placa de cobre metálico no seu interior e outro contendo solução de sulfato de cobre um molar com uma placa de zinco metálico.
7) A função da ponte salina é:
a) Conduzir os ânions cloro para solução de sulfato de zinco e cátions potássio K+ para a solução de sulfato de cobre.
b) Conduzir cátions da solução de sulfato de cobre para a ponte salina que se carrega de carga elétrica.
c) Conduzir íons, ânions e cátions.
d) Conduzir o cobre livre da solução de sulfato de cobre para a solução de sulfato de zinco.
e) Conduzir elétrons da solução de sulfato de cobre para a solução de sulfato de zinco.
8) Em relação a produção de energia na pilha de Daniel, esta se divide em duas partes funcionais.
b) A meia reação da semi-pilha de zinco produz 0,96 V e a meia reação da semi-pilha de cobre é de 1,33 V. No total a pilha de Daniel produz uma corrente elétrica de 110 V.
c) A meia reação da semi-pilha de zinco produz -0,44 V e a meia reação da semi-pilha de cobre é de -1,66 V. No total a pilha de Daniel produz uma corrente elétrica de 1,10 V.
d) A meia reação da semi-pilha de zinco produz -2,37 V e a meia reação da semi-pilha de cobre é de 0,34 V. No total a pilha de Daniel produz uma corrente elétrica de 110 V.
e) A meia reação da semi-pilha de zinco produz 0,80 V e a meia reação da semi-pilha de cobre é de 0,34 V. No total a pilha de Daniel produz uma corrente elétrica de 1,10 V.
9) A pilha de Daniel produz uma corrente elétrica de 1,10 volts/segundo, do eletrodo de zinco para o eletrodo de cobre. A quantos elétrons corresponde essa movimentação pelo condutor? Dados: 1 volt = 6,28 x 1018 e-/s.
a) 6,28 x 1018 e-/s
b) 8,908 x 1018 e-/s
c) 6,908 x 1018 e-/s
d) 6,908 x 1016 e-/s
e) 7,908 x 1018 e-/s
10) (Adaptado) Ao acender uma lanterna á pilha, ocorre uma reação no interior da pilha chamada de:
Bibliografia
Bianchi, Albrecht, Daltamir. Universo da Química - volume único. Ed. FTD. P. 484 - 531.
Calculo detalhado para transformar Ampere em Watts - Vida e ...
anjoneto.blogspot.com/2009/11/calculo-detalhado-para-transformar.html
Martha Reis. Completamente Química - Físico-química, livro do professor, volume 2. Editora FTD. P. 4290, 468.
a) redução
b) oxirredução
c) neutralização
d) fermentação
e) dupla troca
Bibliografia
Bianchi, Albrecht, Daltamir. Universo da Química - volume único. Ed. FTD. P. 484 - 531.
Calculo detalhado para transformar Ampere em Watts - Vida e ...
anjoneto.blogspot.com/2009/11/calculo-detalhado-para-transformar.html
Martha Reis. Completamente Química - Físico-química, livro do professor, volume 2. Editora FTD. P. 4290, 468.
loading...
- Pilhas E Baterias: Uma Oxidação útil
Bateria de níquel-cádmio: presente em telefones.Pilhas e baterias são dispositivos nos quais uma reação espontânea de oxirredução produz corrente elétrica. Não é apropriado saber sobre a aplicação dos vários tipos de pilhas e baterias...
- Eletrólise
Eletrólise Eletrólise A eletrólise de um modo geral é caracterizada por ser um processo de oxirredução ou de obtenção de íons livres com...
- Metais Pesados
Bolsista Luzia M. dos Santos Olá amigos do blog, hoje vamos falar dos elementos químicos metálicos, especificamente dos metais pesados.Mas afinal o que é um metal pesado?O termo metal pesado é utilizado para os metais que possuem densidade superior...
- Se A Vida Te Der Limões Faça Uma Pilha!
Bolsista:Marielle Toledo Silva Que tal aprenderfazer uma pilha bem legal,utilizando apenas limões, fios de cobre e parafusos é só seguir os passos abaixo: Pilha de limão Figura1: Imagem de um sistema para montagem da pilha de limão...
- Origem Das Pilhas
Bolsista: Walmira Gomes Olá galera do QUIPIBID! Vocês sabiam que a história das pilhas começou em uma situação acidental? Inicialmente envolvendo Luigi Galvani, mas quem de fato explicou corretamente a sua origem...
